LIETUVOS RESPUBLIKOS SVEIKATOS APSAUGOS MINISTRAS
Į S A K Y M A S
DĖL LIETUVOS RESPUBLIKOS SVEIKATOS APSAUGOS MINISTRO 2003 M. GRUODŽIO 23 D. ĮSAKYMO NR. V-757 „DĖL LIETUVOS HIGIENOS NORMOS HN 62:2003 „KOSMETIKOS GAMINIAI: BENDRIEJI REIKALAVIMAI, DRAUDŽIAMOS IR RIBOJAMOS MEDŽIAGOS“ PATVIRTINIMO“ PAKEITIMO
2004 m. rugpjūčio 11 d. Nr. V-564
Vilnius
Vykdydamas Lietuvos Respublikos pozicijos Europos Sąjungos institucijose nagrinėjamais klausimais rengimo, derinimo, pristatymo bei Europos Sąjungos teisės (acquis communautaire) perkėlimo į Lietuvos Respublikos nacionalinę teisę ir jos įgyvendinimo koordinavimo tvarkos, patvirtintos Lietuvos Respublikos Vyriausybės 2004 m. sausio 9 d. nutarimu Nr. 21 (Žin., 2004, Nr. 8-184), 32 punktą, įgyvendindamas 2003 m. vasario 27 d. Europos Parlamento ir Tarybos direktyvą 2003/15/EB, iš dalies pakeičiančią Tarybos direktyvą 76/768/EEB dėl valstybių narių įstatymų, susijusių su kosmetikos gaminiais, suderinimo, 2003 m. rugsėjo 5 d. Komisijos direktyvą 2003/80/EB, nustatančią Tarybos direktyvos 76/768/EEB VIII a priede pateikiamą kosmetikos produktų ilgaamžiškumo simbolį, 2003 m. rugsėjo 24 d. Komisijos direktyvą 2003/83/EB, derinančią su technikos pažanga Tarybos direktyvos 76/768/EEB II, III ir VI priedus:
1. Pakeičiu Lietuvos higienos normą HN 62:2003 „Kosmetikos gaminiai: bendrieji reikalavimai, draudžiamos ir ribojamos medžiagos“, patvirtintą Lietuvos Respublikos sveikatos apsaugos ministro 2003 m. gruodžio 23 d. įsakymu Nr. V-757 „Dėl Lietuvos higienos normos HN 62:2003 „Kosmetikos gaminiai: bendrieji reikalavimai, draudžiamos ir ribojamos medžiagos“ patvirtinimo“ (Žin., 2004, Nr. 21-647):
1.1. Išdėstau 3.8 punktą taip:
„3.8. Lietuvos Respublikos valstybinės maisto ir veterinarijos tarnybos direktoriaus 2004 m. sausio 16 d. įsakymas Nr. B1-45 „Dėl Užkrečiamųjų spongiforminių encefalopatijų prevencijos, kontrolės ir likvidavimo taisyklių patvirtinimo“ (Žin., 2004, Nr. 19-611).“
1.2. Papildau nauju 3.9 punktu:
„3.9. Lietuvos Respublikos aplinkos ministro ir Lietuvos Respublikos sveikatos apsaugos ministro 2000 m. gruodžio 19 d. įsakymas Nr. 532/742 „Dėl Pavojingų cheminių medžiagų ir preparatų klasifikavimo ir ženklinimo tvarkos“ (Žin., 2001, Nr. 16-509).“
1.3. Papildau naujais 4.9, 4.10 punktais:
„4.9. gatavas kosmetikos gaminys – į rinką pateiktas galutinės sudėties kosmetikos gaminys, kurį gali įsigyti vartotojas, taip pat gaminio prototipas;
1.4. Papildau naujais 5.12, 5.13 punktais:
„5.12. OECD – Ekonominio bendradarbiavimo ir plėtros organizacija (Organisation for Economic Cooperation and Development).“
1.5. Išdėstau 9 punktą taip:
„9. Nepažeidžiant šios higienos normos 6 punkto reikalavimų draudžiama:
9.1. tiekti į rinką gatavus kosmetikos gaminius, kurie, nustatant jų atitiktį šios higienos normos reikalavimams, buvo bandomi su gyvūnais kitu, o ne alternatyviu metodu po to, kai toks alternatyvus metodas buvo įteisintas ir priimtas Europos Bendrijos lygiu, atsižvelgiant į OECD vykdomą alternatyvių metodų įteisinimo eigą;
9.2. tiekti į rinką gatavus kosmetikos gaminius, turinčius ingredientų arba jų derinių, kurie, nustatant jų atitiktį šios higienos normos reikalavimams, buvo bandomi su gyvūnais kitu, o ne alternatyviu metodu po to, kai toks alternatyvus metodas buvo įteisintas ir priimtas Europos Bendrijos lygiu, atsižvelgiant į OECD vykdomą alternatyvių metodų įteisinimo eigą;
9.3. šalyje bandyti su gyvūnais gatavus kosmetikos gaminius nustatant jų atitiktį šios higienos normos reikalavimams;
9.4. šalyje bandyti su gyvūnais kosmetikos gaminių ingredientus arba ingredientų derinius nustatant jų atitiktį šios higienos normos reikalavimams vėliausiai nuo tos dienos, nuo kurios reikalaujama šiuos bandymus pakeisti vienu arba keliais įteisintais alternatyviais metodais, išvardytais 1967 m. birželio 27 d. Tarybos direktyvos 67/548/EEB dėl pavojingų medžiagų klasifikavimą, pakavimą ir ženklinimą reglamentuojančių įstatymų ir kitų teisės aktų suderinimo V priede.“
1.6. Papildau nauju 10 punktu:
„10. Įgyvendinant šios higienos normos 9 punkto reikalavimus, turi būti laikomasi Europos Komisijos parengtų bandymų su gyvūnais laipsniško nutraukimo galutinių terminų.
10.1. Esant išskirtinėms aplinkybėms, jei kyla didelis susirūpinimas dėl kosmetikos gaminio ingrediento rizikos sveikatai, kompetentinga institucija inicijuoja kreipimąsi į Komisiją leisti taikyti nuostatą, leidžiančią nukrypti nuo šios higienos normos 9 punkto reikalavimų. Prašyme pateikiamas padėties įvertinimas ir nurodomos būtinos priemonės.
10.2. Komisija gali leisti taikyti nuostatas, leidžiančias nukrypti nuo 9 punkto reikalavimų, jei:
10.2.1. ingredientas plačiai naudojamas ir negali būti pakeistas kitu ingredientu, turinčiu panašią funkciją;
10.3. Sprendimas dėl leidimo, jo taikymo sąlygos ir gautas galutinis rezultatas yra šalies metinės ataskaitos, kurią, atsižvelgiant į pažangos siekimą taikant alternatyvius tyrimo metodus, reikia pateikti Europos Komisijai, dalis. Ataskaitoje turi būti tikslūs duomenys apie kosmetikos gaminių bandymų, atliktų su gyvūnais, skaičių ir tipą. Ši informacija kartu su statistiniais duomenimis turi būti renkama ir teikiama Europos Komisijai, kaip nustatyta 1986 m. lapkričio
24 d. Tarybos direktyvoje 86/609/EEB dėl valstybių narių įstatymų ir kitų teisės aktų, susijusių su eksperimentiniais ir kitais mokslo tikslais naudojamų gyvūnų apsauga, suderinimo.“
1.9. Išdėstau 15 punktą taip:
„15. Šios higienos normos 2 priede išvardytos medžiagos negali būti panaudotos kaip ingredientai kosmetikos gaminių gamyboje. Gatavame kosmetikos gaminyje gali būti šios higienos normos 2 priede išvardytų medžiagų likučių, kurie pagal Lietuvos higienos normos HN 101:2001 [3.4] reikalavimus techniškai neišvengiami geros gamybos praktikos procese ir nekelia pavojaus žmogaus sveikatai.“
1.10. Papildau nauju 16 punktu:
„16. Kosmetikos gaminiuose draudžiama naudoti chemines medžiagas, kurios Pavojingų cheminių medžiagų ir preparatų klasifikavimo ir ženklinimo tvarkos Suklasifikuotų cheminių medžiagų sąraše [3.9], atsižvelgiant į techninę pažangą, klasifikuojamos kaip 1-os, 2-os ir 3-os kategorijos kancerogeninės, mutageninės arba toksiškos reprodukcijai medžiagos. Cheminė medžiaga, priskirta 3-iai kategorijai, gali būti naudojama kosmetikos gaminiuose, jei SCCNFP ją įvertina ir nustato, kad ji tinkama naudoti kosmetikos gaminiuose.“
1.12. Išdėstau 22 punktą taip:
1.13. Išdėstau 26 punktą taip:
„26. Ant tiekiamo į rinką kosmetikos gaminio pirminės ir antrinės pakuotės neištrinamomis, įskaitomomis ir gerai matomomis raidėmis turi būti pateikta ši informacija:
26.1. Europos Bendrijoje įsisteigusio gamintojo ar asmens, atsakingo už kosmetikos gaminio patiekimą į rinką, pavadinimas ar ženklas, adresas ar pagrindinės buveinės registracijos adresas: gaminio kilmės šalis, jeigu pagaminta ne Europos Bendrijoje. Jeigu gaminys gaminamas keliose Europos Bendrijos teritorijos vietovėse, gamintojas gali pasirinkti vieną gamybos vietovę, kurioje bus galima gauti būtinąją kosmetikos gaminio informaciją. Tais atvejais kosmetikos gaminio etiketėje šalia gamintojo ar atsakingo už kosmetikos gaminio patiekimą į rinką asmens adreso turi būti parašomas ir pabraukiamas tokios vietovės adresas. Ši informacija gali būti pateikta sutrumpina, tačiau aiški, kad galima būtų identifikuoti adresatą;
26.2. vardinis gaminio kiekis pagal masę ar tūrį pakavimo metu, išskyrus mažesnes kaip penkių gramų ar mililitrų, taip pat vienkartines pakuotes bei nemokamus pavyzdžius. Fasuotų gaminių, parduodamų vienetais ir kurių svoris ar tūris nėra svarbūs, svorio ar tūrio nurodyti nebūtina, jei ant pakuotės užrašomas vienetų skaičius. Jei vienetų skaičius matyti neatplėšus pakuotės, skaičiaus rašyti nereikia;
26.3. minimalus gaminio tinkamumo naudoti terminas. Kosmetikos gaminiams, kurių minimalus tinkamumo terminas yra trumpesnis kaip 30 mėnesių, jis turi būti pateiktas aiškiai užrašant mėnesį ir metus po žodžių „Geriausiais naudoti iki pabaigos …“ arba nurodant pakuotės vietą, kur užrašyta data. Jei gaminio minimalus tinkamumo terminas priklauso nuo papildomų ar tam tikrų laikymo sąlygų, turi būti pateikta informacija apie teisingas laikymo sąlygas;
26.4. kosmetikos gaminiams, kurių tinkamumo terminas ilgesnis kaip 30 mėnesių, turi būti nurodytas laikotarpis nuo pakuotės atidarymo, per kurį gaminys gali būti naudojamas visiškai nepakenkiant vartotojui. Tokia informacija pažymima šios higienos normos 12 priede pateiktu simboliu ir nurodant minėto laikotarpio trukmę (mėnesiais ir/arba metais);
26.5. ypatingi atsargumo įspėjimai, kurių būtina laikytis naudojant gaminį, ir ypač nurodyti šios higienos 3, 4, 5 ir 6 priedų lentelių skiltyse „Naudojimo sąlygos ir įspėjimai, kurie turi būti išspausdinti etiketėje“. Aerozoliniai kosmetikos gaminiai turi būti ženklinami papildomais rekvizitais pagal Aerozolių balionėlių saugos techninio reglamento (atitinkančio direktyvas 75/234 EEB ir 94/1 EEB) reikalavimus [3.3]. Turi būti ir speciali įspėjamoji informacija profesionalams, ypač kirpyklose, skirtiems gaminiams;
26.6. gaminio pagaminimo partijos numeris ar kitas žymuo, pagal kurį galima identifikuoti gaminį (nustatyti gaminio pagaminimo datą ir vietą). Jei dėl mažo gaminio pirminės pakuotės dydžio negalima ant jos nurodyti pagaminimo partijos numerio ar kito identifikavimo ženklo, ta informacija turi būti ant antrinės pakuotės;
26.8. ingredientų sąrašas, kuris gali būti pateiktas ant pirminės ar antrinės pakuotės arba vien tik ant antrinės pakuotės. Sąrašas turi prasidėti žodžiu Ingredients:, o po jo išvardyti Bendrojoje nomenklatūroje [3.7] įrašytų ingredientų INCI pavadinimai. Jeigu kosmetikos gaminio ingrediento INCI pavadinimo nėra, turi būti rašomas cheminis ar IUPAC arba INN, arba Europos farmakopėjos vartojamas pavadinimas. Sąraše ingredientai turi būti surašyti jų panaudoto kiekio mažėjimo tvarka. Mažesnės kaip 1 % koncentracijos ingredientai gali būti išvardyti bet kokia tvarka po tų ingredientų, kurių koncentracija didesnė kaip 1 %. Kvėpikliai, aromatinės kompozicijos bei jų žaliavos apibūdinami žodžiais „parfum“ ar „aroma“. Tačiau medžiagos, kurios turi būti nurodytos ženklinant gaminį, kaip reikalaujama šios higienos normos 3 priedo I skyriaus lentelės skiltyje „Kiti apribojimai ir reikalavimai“ 67–92 pozicijose, turi būti įvardytos ingredientų sąraše, neatsižvelgiant į jų paskirtį. Dažikliai gali būti išvardyti po kitų ingredientų bet kokia tvarka pagal spalvos indekso numerį arba pavadinimą, kuriuo jis įvardytas šios higienos normos 4 priede. Įvairių atspalvių dekoratyvinės kosmetikos gaminiams gali būti surašomi visi atspalviniai dažikliai po žodžių: „may contain“ (sudėtyje gali būti) arba po simbolio: [+/-].
Jei gaminio sudėtyje yra vienas ar keli išimties tvarka įslaptinti ingredientai, užregistruoti šios higienos normos 10 priede nustatyta tvarka, sąraše turi būti parašytas to (-ų) ingrediento (-ų) registracijos numeris (-iai).
1.14. Išdėstau 27 punktą taip:
„27. Jei šios higienos normos 26.5 ir 26.8 punktuose reikalaujamos informacijos (ypatingi atsargumo įspėjimai ir ingredientų sąrašai) negalima pažymėti ant gaminio pirminės ar antrinės pakuotės dėl jos dydžio, formos, ši informacija turi būti pateikta lapelyje, juostelėje, kortelėje, pridedamoje arba pritvirtinamoje prie gaminio, o apie jų buvimą informuojamas vartotojas, išspausdinant ant pirminės ar antrinės pakuotės sutrumpintą informaciją ar šios higienos normos 7 priede pavaizduotą simbolį.“
1.15. Išdėstau 29 punktą taip:
1.16. Išdėstau 31 punktą taip:
„31. Jei gamintojas ar asmuo, atsakingas už gaminio pateikimą į rinką, neatliko ar neužsakė atlikti gatavo gaminio, gaminio prototipo ar kurio nors gaminyje esančio ingrediento bandymų su gyvūnais arba nenaudojo gaminiui ingrediento, kuris kitų buvo bandomas su gyvūnais, kuriant naują kosmetikos gaminį, gamintojas ar asmuo, atsakingas už gaminio pateikimą į Europos Bendrijos rinką, gali ant gaminio pakuotės arba prie gaminio pridedamame ar gaminį apibūdinančiame dokumente, pranešime, etiketėje, lapelyje, juostelėje ar kortelėje nurodyti, kad bandymai su gyvūnais nebuvo atlikti. Tam turi būti naudojami Europos Komisijos rekomendacijomis priimti ir nustatyta tvarka patvirtinti nuorodų tekstai.“
1.17. Išdėstau 2 priedo 178 poziciją taip:
| 1 |
2 |
3 |
„178 |
4-benziloksifenolis ir 4-etoksifenolis |
4-Benzyloxyphenol and 4-ethoxyphenol“ |
1.19. Išdėstau 2 priedo 411 poziciją taip:
| 1 |
2 |
3 |
| „411 |
Antriniai alkil- ir alkanolaminai ir jų druskos |
Secondary alkyl-and alkanolamines and their salts“ |
1.20. Išdėstau 2 priedo 419 poziciją taip:
| 1 |
2 |
3 |
| „419 |
Nurodytos pavojingos medžiagos, išvardytos Užkrečiamųjų spongiforminių encefalopatijų prevencijos, kontrolės ir likvidavimo taisyklių [3.8] 4 ir 10 prieduose (atitinkančiuose Europos Parlamento ir Tarybos reglamentą (EB) Nr. 999/2001) |
From the date referred to in Article 22(1) of Regu-lation (EC) No 999/2001 of the European Parliament and of the Council, of the specified risk as designated in Annex V to that Regulation, and ingredients derived there-from. Until that date, the specified risk materials as designated in Annex XI Part A to Regulation (EC) No 999/2001, and ingredients derived therefrom. (OJ L 147, 31.5.2001. p.1)“ |
1.21. Išdėstau 3 priedo I skyriaus 14 poziciją taip:
| 1 |
2 |
3 |
4 |
5 |
6 |
| „14 |
Hidrochinonas1) (Hydroquinone) |
a) Oksiduo-jantieji plaukų dažikliai |
0,3 % |
|
a) 1. Nenaudoti blakstienoms ar antakiams dažyti |
|
|
|
1. Ne profesionalams |
|
|
Gaminiui patekus į akis, nedelsiant išplauti Sudėtyje yra hidrochinono |
|
|
|
2. Profesio-nalams
b) Dirbtinių nagų sistemos |
0,02 % (paruoštame naudoti) |
Skirta tik profesionalams
|
2. Skirta tik profesionalams Sudėtyje yra hidrochinono Gaminiui patekus į akis, nedelsiant išplauti b) Skirta tik profesionalams Vengti sąlyčio su oda Atidžiai perskaityti naudojimo instrukcijas“ |
1.22. Išdėstau 3 priedo I skyriaus 60–62 pozicijas taip:
| 1 |
2 |
3 |
4 |
5 |
6 |
| „60 |
Riebalų rūgščių dialkilamidai ir dialkanolamidai (Fatty acid dialkylamides and dialkanolamines) |
|
Antrinio amino ne daugiau kaip 0,5 % |
Nenaudoti nitrozinimo sistemose Grynumas ne mažesnis kaip 99 % Antrinio amino ne daugiau kaip 5 % (taikoma žaliavoms) Nitrozamino ne daugiau kaip 50 μg/kg Laikyti nenitritinėse talpyklose |
|
| 61 |
Monoalkanolaminai, monoalkilaminai ir jų druskos (Monoalkylamines, monoalkanolamines and their salts) |
|
Antrinio amino ne daugiau kaip 0,5 % |
Nenaudoti nitrozinimo sistemose Grynumas ne mažesnis kaip 99 % Antrinio amino ne daugiau kaip 5 % (taikoma žaliavoms) |
|
|
|
|
|
|
Nitrozamino ne daugiau kaip 50 μg/kg Laikyti nenitritinėse talpyklose |
|
| 62 |
Trialkilaminai, trialkanolaminai ir jų druskos (Trialkylamines, trialkanolamines and their salts)
|
a) Nenuplauna-mieji gaminiai b) Kiti gaminiai |
a) 2,5 % |
a), b) Nenaudoti nitrozinimo sistemose Grynumas ne mažesnis kaip 99 %
|
|
|
|
|
|
|
Antrinio amino ne daugiau kaip 5 % (taikoma žaliavoms) Nitrozamino ne daugiau kaip 50 μg/kg Laikyti nenitritinėse talpyklose“ |
|
1.23. Išdėstau 3 priedo I skyriaus 93 poziciją taip:
| 1 |
2 |
3 |
4 |
5 |
6 |
| „93 |
2,4-diaminopirimidin-3-oksidas (CAS Nr. 74638-76-9) (2,4-Diamino-pyrimidine-3-oxide) |
Plaukų priežiūros preparatai |
1,5 %“
|
|
|
|
|
|
|
|
1.24. Papildau 3 priedo I skyrių naujomis 94,95 pozicijomis:
| 1 |
2 |
3 |
4 |
5 |
6 |
| „94 |
Benzoilperoksidas (Benzoyl peroxide) |
Dirbtinių nagų sistemos |
0,7 % (po sumaišymo) |
Naudoti tik profesionalams |
Naudoti tik profesionalams Vengti sąlyčio su oda Atidžiai perskaityti naudojimo instrukcijas |
| 95 |
Hidrochinonmetileteris (Hydroquinone methylether) |
Dirbtinių nagų sistemos |
0,02 % (po sumaišymo) |
Naudoti tik profesionalams |
Naudoti tik profesionalams Vengti sąlyčio su oda Atidžiai perskaityti naudojimo instrukcijas“ |
1.25. Papildau 3 priedo I skyrių nauja 96 pozicija:
| 1 |
2 |
3 |
4 |
5 |
6 |
| „96 |
Glikolio ir pieno rūgštys, jų druskos ir esteriai (Glycolic and lactic acid, their salts and esters) |
1. Ne profesionalams
2. Profesionalams |
≤ 10 %, perskaičiavus į rūgštį, pH ≥ 3,5
2. ≤ 30 %, perskaičiavus į rūgštį, pH ≥ 3,0 |
|
1 ir 2 Po panaudojimo vengti tiesioginių saulės spindulių Kasdien naudoti odos apsaugos priemones su ultravioletinių spindulių filtrais“ |
1.26. Išdėstau 3 priedo II skyriaus 61, 62 pozicijas taip:
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| „61 |
Muskuso ksilenas (Musk xylene) (CAS Nr. 81-15-2) |
Visi kosmetikos gaminiai, išskyrus burnos priežiūros gaminius |
a) 1,0 % aukštos kokybės kvepaluose |
|
|
2004 09 30 |
|
|
|
|
b) 0,4 % tualetiniame vandenyje c) 0,03 % kituose gaminiuose |
|
|
|
| 62 |
Muskuso ketonas (Musk ketone) (CAS Nr. 81-14-1)
|
Visi kosmetikos gaminiai, išskyrus burnos priežiūros gaminius |
a) 1,4 % aukštos kokybės kvepaluose b) 0,56 % tualetiniame vandenyje c) 0,042 % kituose gaminiuose |
|
|
2004 09 30“ |
1.27. Išdėstau 5 priedo 36 poziciją taip:
| 1 |
2 |
3 |
4 |
5 |
| „36 |
1,2-dibrom-2,4-dicianobutanas (metildibromglutaronitrilas) 1,2-Dibromo-2,4-dicyanobutane (methyldibromo glutaronitrile) |
0,1% |
Tik nuplaunamuose gaminiuose“ |
|
1.28. Išdėstau 8 priedo 1.4 punktą taip:
„1.4. gatavo kosmetikos gaminio saugos žmogaus sveikatai įvertinimo duomenys pagal ingredientų bendrąjį toksiškumą, jų cheminę sandarą bei ekspozicijos lygį. Ypač turi būti atsižvelgta į tų teritorijų vietovių, kur gaminys bus naudojamas, arba į populiacijos, kuriai gaminys yra skirtas, specifines ekspozicijos savybes. Be to, turi būti specialus kosmetikos gaminių, skirtų jaunesniems kaip trejų metų vaikams, ir intymiosios higienos kosmetikos gaminių įvertinimas (saugos žmogaus sveikatai įvertinimas atliekamas pagal geros laboratorinės praktikos reikalavimus (Europos Parlamento ir Tarybos direktyva 2004/10/EB);“.
1.29. Papildau 8 priedą naujais 1.8, 1.9 punktais:
„1.8. duomenis apie visus gamintojo, jo atstovų arba tiekėjų atliktus bandymus su gyvūnais, kuriant gaminį arba įvertinant gaminio ir jo ingredientų saugą, įskaitant visus bandymus su gyvūnais, atliktus vykdant valstybių ne Europos Sąjungos narių įstatymų arba reglamentų reikalavimus;
1.9. informacija, kurią reikia pateikti pagal šio priedo 1.1 ir 1.6 punktus, turi būti lengvai prieinama visuomenei visomis tinkamomis priemonėmis, įskaitant ir elektronines, nepažeidžiant komercinių paslapčių ir intelektinės nuosavybės teisių apsaugos. Viešai prieinama kiekybinė informacija, kurią reikia pateikti pagal šio priedo 1.1 punktą, turi apsiriboti pavojingomis cheminėmis medžiagomis, įtrauktomis į Pavojingų cheminių medžiagų ir preparatų ženklinimo ir klasifikavimo tvarkos Suklasifikuotų cheminių medžiagų sąrašą [3.9].“.
1.30. Išdėstau 8 priedo 2 punktą taip:
„2. Jei toks pats kosmetikos gaminys gaminamas keliose Europos Bendrijos teritorijos vietose, gamintojas gali pasirinkti vieną gamybos vietovę, kurioje būtinoji kosmetikos gaminio informacija bus lengvai prieinama. Atsižvelgdamas į kontrolės reikalavimus, pasirinktos vietovės adresą gamintojas privalo nurodyti kontrolės institucijai.“
1.32. Išdėstau 9 priedą nauja redakcija:
„Lietuvos higienos normos HN 62:2003
„Kosmetikos gaminiai: bendrieji reikalavimai,
draudžiamos ir ribojamos medžiagos“
9 priedas
Kosmetikos gaminių ingredientų, neįtrauktų į šios higienos normos 2, 3, 4, 5, 6 priedus, ribojimo naudoti tvarka
1. Kompetentinga įstaiga, nepažeisdama šios higienos normos 14 punkto reikalavimų, gali su tam tikrais apribojimais leisti naudoti Lietuvos teritorijoje medžiagas, neįtrauktas į šios higienos normos 2, 3, 4, 5 ir 6 priedus, tam tikruose kosmetikos gaminiuose, nurodytuose nacionaliniame sprendime, laikantis šių sąlygų:
1.2. turi būti vykdoma valstybinė kontrolė tų kosmetikos gaminių, kuriuose yra laikinai su tam tikrais apribojimais leistų medžiagų ar preparatų;
2. Kompetentinga įstaiga per du mėnesius nuo nacionalinio sprendimo įsigaliojimo datos Europos Komisijai bei valstybėms narėms turi pateikti sprendimą dėl ingrediento apribojimo (sprendimo tekstą).
3. Baigiantis trejų metų sprendimo galiojimo terminui, kompetentinga įstaiga gali pateikti Europos Komisijai prašymą dėl ribojamų Lietuvoje ingredientų įtraukimo į ribojamų medžiagų sąrašą. Taip pat pateikiami aiškinamieji dokumentai, kuriuose išdėstomos priežastys, pagrindžiančios šį prašymą, bei nurodoma medžiagos ar preparato naudojimo paskirtis.
4. Per 18 mėnesių nuo prašymo įteikimo Europos Komisija nustatyta tvarka, remdamasi naujausiomis mokslo ir technikos žiniomis, po konsultacijų su SCCNFP, surengtų Komisijos ar valstybės narės iniciatyva, priima sprendimą dėl galimo medžiagos ar preparato įtraukimo į ribojamų naudoti kosmetikos gaminių gamybai ingredientų sąrašus arba dėl nacionalinio sprendimo panaikinimo.“.
1.33. Papildau nauju 12 priedu:
„Lietuvos higienos normos HN 62:2003
„Kosmetikos gaminiai: bendrieji reikalavimai,
draudžiamos ir ribojamos medžiagos“
12 priedas
atidaryto indelio SIMBOLIS
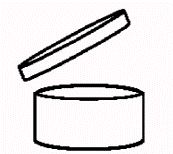 |
2. Nustatau, kad:
2.1. šio įsakymo 1.3–1.6, 1.10, 1.13 punkto 5 pastraipa, 1.16, 1.28, 1,29, 1.32 punktai įsigalioja nuo 2004 m. rugsėjo 11 d.;
2.2. nuo 2005 m. kovo 11 d. draudžiama tiekti į rinką kosmetikos gaminius, neatitinkančius šio įsakymo 1.13 punkto 5 pastraipos reikalavimų;
2.4. nuo 2005 m. kovo 24 d. draudžiama tiekti į rinką kosmetikos gaminius, neatitinkančius šio įsakymo 1.17–1.19, 1.21–1.24, 1.27 punktų reikalavimų;
3. Pavedu:
3.1. Valstybinei visuomenės sveikatos priežiūros tarnybai prie Sveikatos apsaugos ministerijos iki 2004 m. gruodžio 31 d. parengti ir pateikti tvirtinti sveikatos apsaugos ministrui:
3.1.1. Informacijos apie kosmetikos gaminio sudėtį ir turimų duomenų apie gaminio nepageidaujamą poveikį pateikimo visuomenei taisyklių projektą;
3.1.2. Statistinių duomenų apie kosmetikos gaminių (ingredientų) bandymų, atliktų su gyvūnais, Lietuvos Respublikoje rinkimo taisyklių projektą;