LIETUVOS RESPUBLIKOS SVEIKATOS APSAUGOS MINISTRO
Į S A K Y M A S
DĖL LIETUVOS HIGIENOS NORMOS HN 106:2001 „NAUJI MAISTO PRODUKTAI IR NAUJI MAISTO INGREDIENTAI“ PATVIRTINIMO
2001 m. gruodžio 29 d. Nr. 683
Vilnius
Vykdydamas Lietuvos Respublikos maisto įstatymo (Žin., 2000, Nr. 32-893) 9 straipsnio 2 dalies 1 ir 4 punktus, Lietuvos Respublikos Vyriausybės 2001 m. vasario 22 d. nutarimą Nr. 192 „Dėl Lietuvos pasirengimo narystei Europos Sąjungoje programos (Nacionalinė ACQUIS priėmimo programa) teisės derinimo priemonių ir ACQUIS įgyvendinimo priemonių 2001 metų planų patvirtinimo“ (Žin., 2001, Nr. 18-554), Lietuvos Respublikos genetiškai modifikuotų organizmų įstatymą (Žin., 2001, Nr. 56-1976), Lietuvos Respublikos Vyriausybės 2001 m. rugsėjo 21 d. nutarimą Nr. 1150 „Dėl valstybinės produktų saugos ekspertizės atlikimo ir apmokėjimo tvarkos patvirtinimo“ (Žin., 2001, Nr. 83-2888):
1. Tvirtinu Lietuvos higienos normą HN 106:2001 „Nauji maisto produktai ir nauji maisto ingredientai“ (pridedama).
2. Pavedu Valstybinės visuomenės sveikatos priežiūros tarnybos prie Sveikatos apsaugos ministerijos direktoriui Vytautui Kriauzai iki 2002 m. birželio 30 d. parengti ir pateikti Sveikatos apsaugos ministerijai tvirtinti įsakymo „Dėl naujų maisto produktų mokslinio komiteto nuostatų ir sudėties patvirtinimo“ projektą.
3. Nustatau, kad Lietuvos higienos norma HN 106:2001 „Nauji maisto produktai ir nauji maisto ingredientai“ įsigalioja 2002 m. liepos 1 d.
PATVIRTINTA
Lietuvos Respublikos
sveikatos apsaugos ministro
2001 m. gruodžio 29 d.
įsakymu Nr. 683
LIETUVOS HIGIENOS NORMA HN 106:2001 „NAUJI MAISTO PRODUKTAI IR NAUJI MAISTO INGREDIENTAI“
I. TAIKYMO SRITIS
1. Ši higienos norma privaloma visiems juridiniams ir fiziniams asmenims, teikiantiems į rinką Lietuvoje pagamintus ar įvežtus naujus maisto produktus bei naujus maisto ingredientus, taip pat valstybės institucijoms, prižiūrinčioms (bei kontroliuojančioms) maisto saugą.
2. Šios higienos normos I-IX skyriai netaikomi maisto priedams, kvapiosioms medžiagoms, ekstrahentams [4.3], taip pat naujiems maisto produktams ir naujiems maisto ingredientams, pagamintiems iki šios higienos normos įsigaliojimo.
II. NUORODOS
4. Šioje higienos normoje yra nuorodos į tokius dokumentus.
4.1. Lietuvos Respublikos genetiškai modifikuotų organizmų įstatymas (Žin., 2001, Nr. 56-1976).
4.2. Lietuvos Respublikos sveikatos apsaugos ministerijos 1998 m. spalio 2 d. įsakymas Nr. 554 „Dėl Lietuvos higienos normos HN 15: 1998 „Maisto higiena“ tvirtinimo“ (Žin., 1998, Nr. 88-2447).
4.3. Lietuvos Respublikos sveikatos apsaugos ministro 1998 m. gruodžio 31 d. įsakymas Nr. 794 „Dėl Lietuvos higienos normos HN 53: 1998 „Leidžiami vartoti maisto priedai“ (Žin., 1999, Nr. 3-76).
4.4. Lietuvos Respublikos ūkio ministerijos 1998 m. balandžio 16 d. įsakymas Nr. 137 „Dėl Lietuvos Respublikoje parduodamų prekių ženklinimo taisyklių patvirtinimo“ (Žin., 1998, Nr. 38-1024).
4.5. Lietuvos Respublikos žemės ūkio ministro 2001 m. birželio 29 d. įsakymas Nr. 224 „Dėl Privalomųjų daržovių sėklų kokybės reikalavimų“ (Žin., 2001, Nr. 58-2110).
III. TERMINAI IR APIBRĖŽIMAI
5. Šioje higienos normoje vartojami terminai ir jų apibrėžimai.
5.1. naujas maisto produktas ir naujas maisto ingredientas
Tai iki šiol Lietuvoje plačiai nevartoti žmonėms skirti maisto produktai ir maisto ingredientai:
5.1.5. kurie susidaro arba yra išskirti iš augalų bei maisto ingredientai, kurie yra išskirti iš gyvūnų, išskyrus maisto produktus ir maisto ingredientus, kurie gaunami tradiciniais dauginimo ar auginimo būdais ir kurie per daugelį metų įsitvirtino kaip saugūs vartoti maisto produktai;
5.3. naujas maisto produktas ar naujas maisto ingredientas, nelygiavertis nurodytajam maisto produktui ar maisto ingredientui
Kai, atlikus tam tikrą esamų duomenų analizę, galima moksliškai įrodyti, kad nustatytoji maisto charakteristika, atsižvelgiant į leidžiamas natūralių svyravimų ribas, skiriasi nuo įprasto maisto produkto ar maisto ingrediento charakteristikos.
5.5. DNR
Dezoksiribonukleorūgštis, kurios yra visose gyvose ląstelėse ir kuri turi informaciją apie ląstelių struktūrą, dermę ir funkcijas.
5.10. genas
Mažiausia DNR molekulės dalis, turinti pakankamai paveldimos informacijos, kad galėtų užkoduoti tam tikrą organizmo požymį ar funkciją.
5.12. genetiškai modifikuotas organizmas
Organizmas, išskyrus žmogų, kurio genetinė medžiaga genų inžinerijos būdu yra taip pakeista ir įgyja tokių savybių, kurių negalėtų atsirasti, organizmui dauginantis natūraliu būdu.
5.13. genetinis stabilumas
Nepasikeitusi organizmo genetinė sandara, kuri perduodama kitoms kartoms.
5.16. imunologiniai metodai
Matavimo metodai, naudojant antikūnus nežinomų medžiagų koncentracijoms nustatyti.
5.18. organizmas
Bet koks biologinis vienetas, galintis daugintis ir (arba) perduoti savo genetinę medžiagą.
5.19. plazmidė(s)
Bakterijose ir tam tikruose kituose organizmuose esančios ekstrachromosominės DNR apskritoji dalis, galinti replikuotis, neatsižvelgdama į chromosomą.
5.20. šalutinis poveikis
Nelauktas poveikis, kurį sukelia geno įterpimas ir kuris trukdo normaliai funkcionuoti kitam genui.
5.21. vektorius
Save replikuojanti DNR molekulė, pakeista, kad galėtų perduoti svetimą DNR segmentą į šeimininko genomą.
IV. ŽYMENYS IR SUTRUMPINIMAI
6. Šioje higienos normoje pavartoti sutrumpinimai:
6.4. OECD – Ekonominio bendradarbiavimo ir plėtros organizacija (Organization for Economic Cooperation and Development);
V. BENDROSIOS NUOSTATOS
7. Naujų maisto produktų ir naujų maisto ingredientų valstybinę saugos ir higieninę ekspertizę atlieka RMC, remdamasis Naujų maisto produktų mokslinio komiteto, mokslo tyrimų įstaigų, komisijų, komitetų, tarybų išvadomis ir rekomendacijomis.
8. Nesant galimybės naujų maisto produktų bei naujų maisto ingredientų saugą įvertinti Lietuvos Respublikoje, RMC turi teisę kreiptis į Europos Komisiją, kad ši paskirtų instituciją, kuri atliks pirminį įvertinimą.
9. Prieš pateikiant prašymą leisti pateikti naują maisto produktą ar naują maisto ingredientą į rinką, pareiškėjas turi pateikti RMC duomenis, kad būtų galima išsiaiškinti, ar aptariamas produktas/ ingredientas laikytinas nauju ir ar pakanka dokumentų ekspertizei atlikti.
11. RMC saugo gautus prašymus, leidimus pateikti naujus maisto produktus ir naujus maisto ingredientus į rinką bei visą pareiškėjo pateiktą informaciją.
12. Dėl bet kokio į šios normos taikymo sritį įeinančio klausimo, galinčio turėti įtakos visuomenės sveikatai, RMC turi konsultuotis su Naujų maisto produktų moksliniu komitetu.
13. Į Naujų maisto produktų mokslinį komitetą turi įeiti šių sričių ekspertai: maisto technologijos, maisto chemijos, biotechnologijos, genų technologijos, toksikologijos, mikrobiologijos, medicinos, mitybos, vartotojų apsaugos, etikos, teisės.
14. Tais atvejais, kai RMC, gavęs naujos informacijos ar peržiūrėjęs esamą, turi pagrįstų priežasčių manyti, kad naujo maisto produkto ar naujo maisto ingrediento vartojimas kelia pavojų žmonių sveikatai ar aplinkai, jis turi teisę kreiptis į Valstybinę maisto ir veterinarijos tarnybą, kad ši laikinai sustabdytų minėtų produktų teikimą į rinką ir vartojimą, kol, remiantis nauja informacija, bus pakartotinai atlikta šių produktų valstybinė saugos ir higieninė ekspertizė.
15. Naujų maisto produktų ir naujų maisto ingredientų saugos kontrolę rinkoje vykdo Valstybinė maisto ir veterinarijos tarnyba.
VI. REIKALAVIMAI NAUJIEMS MAISTO PRODUKTAMS IR NAUJIEMS MAISTO INGREDIENTAMS
17. Nauji maisto produktai ir nauji maisto ingredientai turi:
18. Pateikiant rinkai naujus maisto produktus ir naujus maisto ingredientus, 21, 22, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33 punktuose nurodyta tvarka taikoma remiantis 17 punkte numatytais kriterijais. Maisto produktų ir maisto ingredientų, gautų iš įvairių rūšių augalų, kuriems taikomi kiti teisės aktai, atveju, šios higienos normos 27-30 punktuose minimas sprendimas dėl leidimo turi būti priimtas atsižvelgiant į tuose teisės aktuose nurodytus vertinimo principus ir šio skyriaus 17 punkte nurodytus kriterijus, išskyrus nuostatas, susijusias su tokių maisto produktų ir maisto ingredientų ženklinimu, kuris privalo atitikti šios higienos normos VIII skyriaus nuostatas.
19. 18 punkte pateikti reikalavimai netaikomi 5.1.2 punkte minimiems maisto produktams ir maisto ingredientams, kai maisto produktų ar maisto ingredientų gamyboje naudotas genetiškai modifikuotas organizmas buvo pateiktas rinkai pagal šioje normoje nustatytus reikalavimus.
20. Taikant išlygas 18 punktui, 23 punkte nurodyta tvarka taikoma 5.1.2, 5.1.4, 5.1.5 punktuose minimiems maisto produktams ir maisto ingredientams, kurie, remiantis esamais ir visuotinai pripažintais moksliniais įrodymais arba remiantis Lietuvos ar užsienio valstybių kompetentingų institucijų išvada, savo sudėtimi, maistine verte, metabolizmu, vartojimo pobūdžiu ir nepageidaujamų juose esančių medžiagų kiekiu yra iš esmės lygiaverčiai esamiems maisto produktams ir maisto ingredientams.
VII. NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ PATEIKIMO Į RINKĄ TVARKA
21. Pareiškėjas privalo pateikti RMC prašymą, kuriame turi būti pateikta informacija, išdėstyta pagal 1 ir 2 priedų reikalavimus, 2 egz., iš kurių vieną RMC perduoda Naujų maisto produktų moksliniam komitetui.
22. RMC pagal 24, 25, 26, 27 punktuose numatytą tvarką atlieka pirminį įvertinimą ir pagal 3 priedo rekomendacijas parengia pirminio įvertinimo ataskaitą bei tuoj pat informuoja pareiškėją apie tai, kad:
22.1. jis gali pateikti maisto produktą ar maisto ingredientą rinkai, jei pirminio įvertinimo ataskaitos sprendime nereikalaujama atlikti papildomą įvertinimą (pagal 26 punktą) ir jei nebuvo pateiktas motyvuotas prieštaravimas (pagal 27 punktą) (pastabos ir prieštaravimai taip pat gali būti susiję su informacijos apie maisto produktus ar maisto ingredientus pateikimu visuomenei ar ženklinimu), arba
23. Pateikdamas rinkai 20 punkte minimus maisto produktus ir maisto ingredientus, pareiškėjas apie tai informuoja RMC. Į šį pranešimą turi būti įtraukta 20 punkte minima atitinkama informacija. Kiekvienais metais tokių pranešimų santrauką RMC centras skelbia oficialaus leidinio „Valstybės žinios“ priede „Informaciniai pranešimai“. Minimų maisto produktų ir maisto ingredientų ženklinimui taikomi šios higienos normos VIII skyriaus reikalavimai.
24. Pareiškėjo prašyme turi būti pateikta reikalinga informacija (įskaitant atliktų tyrimų medžiagą bei bet kokią kitą turimą medžiagą, įrodančią, kad maisto produktas ar maisto ingredientas atitinka 17 punkte numatytus reikalavimus) ir atitinkamas pasiūlymas dėl informacijos apie maisto produktų ar maisto ingredientų pateikimo visuomenei ar ženklinimo, remiantis šios higienos normos VIII skyriuje numatytais ženklinimo reikalavimais. Prie prašymo turi būti pridėta visų dokumentų santrauka.
25. Gavęs prašymą, RMC užtikrina, kad būtų atliktas pirminis įvertinimas. Jeigu Lietuvoje nėra galimybių atlikti pirminį įvertinimą, vadovaujamasi šios higienos normos 8 punkte numatyta tvarka.
26. Per tris mėnesius nuo prašymo, atitinkančio šios higienos normos 24 punkto reikalavimus bei 1 ir 2 prieduose išdėstytas rekomendacijas, gavimo, pagal 3 priede išdėstytas rekomendacijas parengiama pirminio įvertinimo ataskaita, kurioje pateikiamas sprendimas dėl maisto produkto ar maisto ingrediento papildomo vertinimo būtinumo.
27. RMC pirminio įvertinimo ataskaitos santrauka skelbiama respublikiniuose dienraščiuose. Per 60 dienų nuo jos paskelbimo dienos visuomenė gali pateikti pastabas ar motyvuotus prieštaravimus dėl minimų maisto produktų ar maisto ingredientų teikimo į rinką. Šios pastabos ar prieštaravimai taip pat gali būti susiję su informacijos apie maisto produktus ar maisto ingredientus pateikimu visuomenei ar ženklinimu. Pastabos ar prieštaravimai pateikiami RMC, kuris, juos įvertinęs, nusprendžia, ar reikalingas papildomas įvertinimas.
28. Jei, remiantis 26 punktu, reikalingas papildomas vertinimas ar pagal 27 punktą yra pareikštas prieštaravimas, sprendimas dėl leidimo priimamas atlikus papildomą vertinimą. Papildomiems tyrimams atlikti bei naujai informacijai gauti reikalingas laikas neįskaičiuojamas į trijų mėnesių laikotarpį, nurodytą 26 punkte, sprendimui pateikti.
29. Sprendime nurodoma:
VIII. REIKALAVIMAI NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ ŽENKLINIMUI
31. Nauji maisto produktai ir nauji maisto ingredientai ženklinami kitų Lietuvos Respublikos teisės aktų nustatyta tvarka [4.4], papildomai laikantis žemiau išvardytų reikalavimų, siekiant užtikrinti, kad galutinis vartotojas gautų informaciją apie:
31.1. charakteristiką apie maisto produktą ar jo savybę (sudėtį, maistinę vertę ar poveikį mitybai, vartojimo paskirtį ir kt.), dėl kurios naujas maisto produktas ar maisto ingredientas tampa nelygiaverčiu jau vartojamam maisto produktui ar maisto ingredientui (šiuo atveju ženklinime turi būti nurodyta modifikuota charakteristika ar savybės, taip pat ir metodas, kurį naudojant ta charakteristika ar savybės buvo įgytos);
31.2. naujame maisto produkte ar maisto ingrediente esančią medžiagą, kurios nėra lygiaverčiame tuo metu vartojamame maisto produkte ir kuri gali turėti pasekmių tam tikrų gyventojų grupių sveikatai;
31.3. naujame maisto produkte ar maisto ingrediente esančią medžiagą, kurios nėra lygiaverčiame tuo metu vartojamame maisto produkte ir kuri gali kelti etinių problemų;
IX. PAPILDOMI REIKALAVIMAI NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ, KURIUOSE YRA GENETIŠKAI MODIFIKUOTŲ ORGANIZMŲ AR KURIE SUSIDEDA IŠ JŲ, TEIKIMUI Į RINKĄ
33. Jei naujame maisto produkte ar naujame maisto ingrediente yra genetiškai modifikuotų organizmų ar jie susideda iš pastarųjų, be 24 punkte nurodytos informacijos, būtina pateikti:
33.1. Lietuvos Respublikos aplinkos ministerijos [4.1] raštišką sutikimą (jei toks yra) dėl sąmoningo genetiškai modifikuotų organizmų išleidimo į aplinką moksliniais ir raidos tikslais, taip pat ir išleidimo(-ų) į aplinką pasekmių, atsižvelgus į bet kokią riziką žmogaus sveikatai ir aplinkai;
34. Jei naujame maisto produkte ar naujame maisto ingrediente yra genetiškai modifikuotų organizmų ar jis susideda iš pastarųjų, 28, 29, 30 punktuose minimas sprendimas dėl leidimo priimamas, atsižvelgiant į reikalavimus aplinkos apsaugai [4.1], kad būtų užtikrinta, jog imtasi visų tinkamų priemonių, užkertant kelią nepalankiems žmogaus sveikatai ir aplinkai veiksniams, galintiems pasireikšti dėl sąmoningo genetiškai modifikuotų organizmų išleidimo į aplinką.
X. ŽENKLINIMO REIKALAVIMAI MAISTO PRODUKTAMS IR MAISTO INGREDIENTAMS, SAVO SUDĖTYJE TURINTIEMS MAISTO PRIEDŲ IR KVAPIŲJŲ MEDŽIAGŲ, KURIE YRA GENETIŠKAI MODIFIKUOTI ORGANIZMAI, JŲ TURI SAVO SUDĖTYJE ARBA YRA IŠ JŲ PAGAMINTI
35. Šiame skyriuje numatomi konkretūs papildomi ženklinimo reikalavimai teikiamiems į rinką ir viešajam maitinimui skirtiems maisto produktams ir maisto ingredientams (toliau – nurodytieji maisto produktai), savo sudėtyje turintiems maisto priedų ir/ar kvapiųjų medžiagų, nurodytų šios higienos normos 36 punkte (toliau – nurodytieji maisto priedai ir kvapiosios medžiagos).
36. Nurodytieji maisto priedai ir kvapiosios medžiagos yra:
36.1. maisto priedai [4.3], kurie yra genetiškai modifikuoti organizmai, jų turi savo sudėtyje arba yra iš jų pagaminti;
37. Teikiami į rinką ir viešojo maitinimo įmonėms skirti nurodytieji maisto produktai ženklinami Lietuvos Respublikos teisės aktų nustatyta tvarka [4.4], papildomai etiketėse pateikiant informaciją apie:
37.1. maisto produkto savybes ar ypatybes (sudėtį, maistinę vertę ar poveikį mitybai, vartojimo paskirtį), dėl kurių nurodytieji maisto priedai ir kvapiosios medžiagos nėra lygiaverčiai esamiems maisto priedams ir kvapiosioms medžiagoms;
37.2. nurodytuosiuose maisto prieduose ir kvapiosiose medžiagose esančią medžiagą, kurios nėra lygiaverčiame esamame maisto priede ar kvapiojoje medžiagoje ir kuri gali turėti poveikio tam tikrų gyventojų grupių sveikatai;
37.3. nurodytuosiuose maisto prieduose ir kvapiosiose medžiagose esančią medžiagą, kurios nėra lygiaverčiame esamame maisto priede ar kvapiojoje medžiagoje ir kuri gali kelti etinių problemų;
38. Nurodytieji maisto priedai ir kvapiosios medžiagos laikomi nelygiaverčiais, kaip nurodyta šios higienos normos 37.1 papunktyje, jei atlikus tam tikrą esamų duomenų analizę galima moksliškai įrodyti, kad jų charakteristikos, atsižvelgiant į visuotinai priimtus natūralius svyravimus, skiriasi nuo įprastinių maisto priedų ar kvapiųjų medžiagų charakteristikų (kai nurodytieji maisto priedai ir kvapiosios medžiagos savo sudėtyje turi baltymų ir/ar DNR, atsiradusių dėl genų modifikacijos).
39. Papildomi ženklinimo reikalavimai:
39.1. dėl 37.1 papunktyje minimos informacijos, yra šie:
žodžiai „pagaminta iš genetiškai modifikuotųIE“ ingredientų sąraše turi būti pateikiami skliausteliuose iškart po nurodytojo maisto priedo ar kvapiosios medžiagos arba šie žodžiai gali būti ingredientų sąrašo ryškiai pateiktose išnašose, nurodytose prie aptariamų maisto priedų ar kvapiųjų medžiagų esančia žvaigždute (*). Išnaša turi būti išspausdinta šriftu, ne mažesniu už ingredientų sąrašo šriftą. Jei nurodytųjų maisto produktų ingredientų sąrašo nėra, šie žodžiai turi būti aiškiai parašyti ant produkto etiketės.
39.2. dėl 37.4 minimos informacijos yra šie:
žodžiai „genetiškai modifikuotaIE“ turi būti ingredientų sąraše iškart po nurodytojo maisto priedo ar kvapiosios medžiagos arba šie žodžiai gali būti ingredientų sąrašo ryškiai pateiktose išnašose, nurodytose prie aptariamų maisto priedų ar kvapiųjų medžiagų esančia žvaigždute (*). Išnaša turi būti išspausdinta šriftu, ne mažesniu už ingredientų sąrašo šriftą. Jei nurodytųjų maisto produktų ingredientų sąrašo nėra, šie žodžiai turi būti aiškiai parašyti ant produkto etiketės.
XI. ŽENKLINIMO REIKALAVIMAI TAM TIKRIEMS MAISTO PRODUKTAMS, PAGAMINTIEMS IŠ GENETIŠKAI MODIFIKUOTOS SOJOS IR KUKURŪZŲ
40. Šie privalomieji ženklinimo reikalavimai taikomi teikiamiems į rinką arba viešojo maitinimo įmonėms skirtiems maisto produktams ir maisto ingredientams (toliau – nurodytieji maisto produktai), pagamintiems iš arba savo sudėtyje turintiems:
41. Nurodytieji maisto produktai ženklinami Lietuvos Respublikos teisės aktų nustatyta tvarka [4.4], papildomai ženklinant:
41.1. jeigu maiste yra daugiau negu viena sudėtinė dalis, sudėtinių dalių sąraše skliausteliuose po ingrediento pavadinimo turi būti atitinkamai įrašyta „Pagaminta iš genetiškai modifikuotos sojos“ arba „Pagaminta iš genetiškai modifikuotų kukurūzų“ arba šie žodžiai gali būti aiškiai matomose ingredientų sąrašo išnašose, į kurias nurodo žvaigždutė (*), esanti prie atitinkamos sudėtinės dalies. Jeigu sudėtinių dalių sąraše jau yra nurodyta, kad ingredientas yra pagamintas iš sojos ar kukurūzų, žodžiai „pagaminta iš genetiškai modifikuotos/ų“ gali būti sutrumpinti „genetiškai modifikuota/i“; jeigu sutrumpinta forma rašoma išnašose, žvaigždutė turi būti žymima prie žodžio „soja“ arba „kukurūzai“. Kai viena ar kita formuluotė rašoma išnašose, šrifto dydis turi būti ne mažesnis kaip ir paties sudėtinių dalių sąrašo šrifto dydis;
41.2. tuo atveju, kai nėra produkto sudėtinių dalių sąrašo, ant maisto produkto etiketės turi būti aiškiai parašyti atitinkami žodžiai „Pagaminta iš genetiškai modifikuotos sojos“ arba „Pagaminta iš genetiškai modifikuotų kukurūzų“;
41.3. jeigu sudėtinė dalis yra įvardyta produkto pavadinimu, šis pavadinimas turi būti papildytas atitinkamais žodžiais „kurios sudėtyje yra IE(*), pagaminta(-as) iš genetiškai modifikuotos sojos/ iš genetiškai modifikuotų kukurūzų“;
(*) nurodomas ingredientas ar ingredientai;
42. Šios higienos normos 41 punkte nurodytieji ženklinimo reikalavimai netaikomi:
42.1. maisto priedams bei kvapiosioms medžiagoms, naudojamiems maisto produktuose, ar ekstrahentams, naudojamiems maisto produktų gamyboje, kaip nurodyta šios higienos normos 2 punkte;
42.2. šios higienos normos 40 punkte nurodytiesiems maisto produktams netaikomi jokie papildomi konkretūs ženklinimo reikalavimai:
42.2.1. kai nei viename atskirame maisto ingrediente arba maisto produkte, susidedančiame iš vieno ingrediento, nėra nei baltymo, nei DNR, kilusių dėl genetinės modifikacijos, nurodytos 40 punkte. Atsižvelgiant į techninius pasiekimus, kitus mokslinius duomenis, turi būti sudarytas nuolat papildomas maisto ingredientų arba iš vieno ingrediento susidedančių maisto produktų, kuriuose nėra nei baltymų, nei DNR, kilusių iš genetiškos modifikacijos, nurodytos 40 punkte, sąrašas;
42.2.2. kai kiekviename atskirame maisto ingrediente arba maisto produkte, turinčiame vieną ingredientą, medžiagos, kilusios iš genetiškai modifikuotų organizmų, nurodytų 40 punkte, kartu su bet kuria kita pagal I-IX skyrius į rinką išleista medžiaga, kilusia iš kitų modifikuotų organizmų, yra ne daugiau kaip 1 %, su sąlyga, kad tos medžiagos yra patekusios atsitiktinai. Tam, kad būtų nustatyta, jog ši medžiaga pateko atsitiktinai, gamintojai privalo kompetentingai institucijai pateikti duomenis, įrodančius, kad jie ėmėsi atitinkamų priemonių maisto produktų gamybai nenaudoti genetiškai modifikuotų organizmų (arba jų produktų).
______________
1 priedas
REKOMENDACIJOS DĖL INFORMACIJOS, KURIĄ BŪTINA PRIDĖTI PRIE PRAŠYMO, SIEKIANT NAUJUS MAISTO PRODUKTUS IR NAUJUS MAISTO INGREDIENTUS TEIKTI RINKAI, MOKSLINIŲ ASPEKTŲ
I. ĮVADAS
1. Visais atvejais, keičiant produkto teikimo rinkai, jo pagaminimo, perdirbimo ar neįprastų ingredientų panaudojimo būdą, būtina aptarti, ar tai turės padarinių vartotojo saugai ir produktų mitybinei vertei. Su šiais aspektais susijusiais klausimais būtina surinkti reikalingą informaciją. Šiuo metu visame pasaulyje diskutuojama dėl naujų maisto produktų saugos. Pasaulio sveikatos organizacija (PSO), Ekonominio bendradarbiavimo ir plėtros organizacija (OECD) ir nacionalinės bei tarptautinės institucijos sprendžia bendrąsias ir specifines naujų maisto produktų sveikumo problemas. Šios srities pasiekimai ir filosofinės kryptys pateikti keliose ataskaitose.
2. Tobulindama Reglamentą (EB) Nr. 258/97 dėl naujų maisto produktų ir naujų maisto ingredientų, Europos Komisija kreipėsi į Maisto produktų mokslinį komitetą (SCF), kad šis parengtų rekomendacijas dėl mokslinių aspektų:
2.1. informacijos, kurią būtina pateikti kartu su prašymu dėl naujų maisto produktų ir naujų maisto ingredientų teikimo rinkai;
II. NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ KATEGORIJOS
III. PAGRINDINĖS PROBLEMOS, SUSIJUSIOS SU NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ VERTINIMU
4.1. Bendrosios pastabos
4.1.1. Maisto produktai – tai paprastai sudėtingi makro- ir mikroelementų mišiniai, kurie žmonėms teikia energiją ir maistines medžiagas ir kurie prisideda prie žmonių gerovės. Tradiciškai jie laikomi natūraliais, naudingais ir būtinais produktais, dėl kurių saugos ir mitybinės vertės abejonių nekyla. Maisto saugos teisės aktuose atsispindi šis požiūris, ir pagrindinis dėmesys juose skiriamas maisto produktų priedams, maistui tvarkyti naudojamoms priemonėms ir natūraliems bei pramoniniams teršalams. Taigi iki šiol maisto produktai nėra sistemiškai įvertinti mitybiniu ar toksikologiniu požiūriu, išskyrus retus atvejus, kai buvo pranešta apie ūmius žmonių apsinuodijimus (pvz., solaninu, cianogeniniais glikozidais) arba kai bandymai su gyvūnais arba žmogaus patirtis atskleidė maisto žaliavų (pvz., žalių sojos miltų) neigiamas pasekmes. Tai nereiškia, kad nebuvo vertinama mitybinė atskirų maisto produktų ar racionų vertė, tačiau ja nebuvo remiamasi nustatant atskirų maisto produktų saugą. Kita vertus, maisto produktuose negalima naudoti maisto priedų, jeigu jie nebuvo išsamiai toksikologiškai įvertinti.
4.1.2. Žinoma, kad įvairūs maisto produktai turi toksinių sudėtinių dalių, tarp jų mutageninių ir kancerogeninių medžiagų. Kai kurios lėtinės žmonių ligos yra maistinės kilmės. Nors ir sutariama dėl to, kad kai kurios neigiamos dietos pasekmės žmonių sveikatai yra susijusios su maistinių medžiagų suvartojimo pobūdžiu, tačiau iki šiol nežinomi tikslūs jų veikimo mechanizmai. Galimas dalykas, kad nuolat vartojamo tradicinio maisto sudėtinės dalys gali sukelti ligą. Iki šiol šiam aspektui ar galimam maisto produktuose esančių medžiagų (pvz., antikancerogeninių), keičiančių maisto toksinį poveikį, vaidmeniui buvo skiriama mažai dėmesio.
4.1.3. Maisto produktų, įskaitant naujų maisto produktų ir naujų maisto ingredientų (NMP), sveikumo įvertinimas sukelia daug sunkumų mokslo srityje. Maisto produktams negalima taikyti įprastų toksikologinio įvertinimo metodų, nes juos vertinant kyla daug sunkumų, su kuriais nesusiduriama, tikrinant maisto priedų ir teršalų kiekį bandymuose in vivo ir in vitro. Pavyzdžiui, į gyvūnų maisto racioną įtraukta maisto dalis, skirta palaikyti jų mitybos balansui atliekant bandymus, negali atlikti įprasto saugos faktoriaus vaidmens, įvertinant ir valdant riziką, susijusią su galimybe jį panaudoti maistui ar kaip esminį maisto ingredientą. Be to, su tokiais sudėtingais cheminiais mišiniais kaip maisto produktai tiesiogiai neatliekami tradiciniai medžiagų apykaitos bei farmakokinetiniai tyrimai. Atliekant mutageninius ir kitus maisto produktų bandymus in vitro, reikia naudoti specialius metodus bei atsargiai interpretuoti rezultatus.
5. Genetiškai modifikuoti organizmai (GMO)
Tarybos direktyvose 90/219/EEB ir 90/220/EEB su paskutiniais pakeitimais, padarytais Komisijos direktyva 94/15/EB, nustatyti reikalavimai dėl informacijos apie maiste esančių genetiškai modifikuotų mikroorganizmų (GMM) bei apgalvoto genetiškai modifikuotų organizmų (GMO) išleidimo į aplinką saugą. Šiose direktyvose nurodyti reikalavimai taip pat tinka tiems GMO, kuriems taikomas Reglamentas (EB) Nr. 258/97 dėl naujų maisto produktų ir naujų maisto ingredientų, ir atitinka pagrindinius informacijos dėl NMP saugos reikalavimus. Šiose rekomendacijose pagrindinis dėmesys skiriamas žmonių vartojamo maisto saugos aspektams.
6. Esminis lygiavertiškumas
6.1. „Esminio lygiavertiškumo“ sąvoką pradėjo vartoti PSO ir OECD, turėdami omenyje maisto produktus, pagamintus naudojantis šiuolaikiniais biotechnologijos metodais. Remiantis OECD, esminio lygiavertiškumo sąvokos idėja yra ta, kad egzistuojantys organizmai, vartojami kaip maisto produktai ar maisto šaltiniai, gali būti lyginami su modifikuotais ar naujais maisto produktais ar maisto komponentais, kai siekiama nustatyti pastarųjų saugą. Jei nustatoma, kad naujas maisto produktas ar maisto komponentas yra iš esmės lygiavertis jau esančiam maisto produktui ar maisto komponentui, saugos požiūriu jis laikomas tokiu pat kaip tradicinis produktas, turint omenyje tai, kad esminio lygiavertiškumo nustatymas nėra produkto saugos ar maistinių savybių įvertinimas, o potencialaus naujo produkto palyginimas su įprastu jo atitikmeniu.
6.2. Esminio lygiavertiškumo principą galima taikyti vertinant maisto produktus, gautus iš naujų šaltinių ar pagamintus naujų procesų metu. Taip iš esmės lygiavertį NMP saugos požiūriu galima lyginti su įprastu jo atitikmeniu. Esminis lygiavertiškumas gali būti nustatytas visam maisto produktui ar maisto komponentui, įskaitant ir „naują“ pakeitimą, arba visam maisto produktui ar maisto komponentui, išskyrus konkretų „naują“ pakeitimą. Jei nustatoma, kad NMP nėra iš esmės lygiavertis jau esančiam maisto produktui ar maisto komponentui, tai nereiškia, kad jis yra nesaugus. Tai reiškia, kad NMP turėtų būti įvertintas atsižvelgiant į jo unikalią sudėtį ir savybes.
6.3. Esminio lygiavertiškumo nustatymas – analitinis uždavinys, kadangi reikia įvertinti reliatyvų NMP sveikumą, palyginti jį su egzistuojančiu maisto produktu ar maisto komponentu. Tai dinamiškas procesas, kadangi dėl nuolat modifikuojamų maisto produktų būtina parengti tokį palyginimo metodą, kuriuo remiantis paskutinis NMP lyginamas su atitinkamu senesniu NMP, o nebūtinai su tradiciškiausiu jo atitikmeniu.
6.4. Palyginimas gali būti ir paprasta, ir sudėtinga užduotis, atsižvelgiant į patirtį ir tiriamo NMP pobūdį. Gyvūnams, augalams, mikroorganizmams, cheminiams maisto ingredientams ir naujiems procesams taikomi skirtingi esminio lygiavertiškumo nustatymo techniniai metodai ir išsamesnis jų aprašymas pagal skirtingas grupes pateiktas toliau šioje rekomendacijoje.
7. Sudėties tyrimas
Analitinis NMP sudėties tyrimas yra labai svarbus ne tik nustatant esminį lygiavertiškumą, bet jis yra ir būtina sąlyga atliekant produkto mitybinį ir toksikologinį įvertinimą. Siekiant užtikrinti duomenų kokybę ir nuoseklumą, būtina standartizuoti ir įteisinti taikomus metodus. Pateikta analizė ir duomenys turėtų remtis patikrintais moksliniais principais ir turėtų būti pritaikyti NMP pobūdžiui. Atliekant tyrimus, pagrindinį dėmesį reiktų skirti pagrindinių maisto medžiagų (makro- ir mikroelementų) sudėčiai ir pagrindinėms toksinėms medžiagoms bei antimitybiniams faktoriams, kurie gali būti būdingi produktui arba atsirasti gamybos proceso metu, nustatyti.
8. Vartojimas
Kai NMP įtraukiamas į maisto racioną, mitybos ir vartojimo pobūdis gali labai smarkiai keistis. Kadangi kartais neįmanoma numatyti tokių įvykių, kartu su NMP marketingu turėtų būti vykdoma stebėjimo programa. Į ją turėtų įeiti informacija apie NPM perdirbimo ar paruošimo sąlygų pasikeitimus bei apie kitų mitybai svarbių maisto produktų ar maisto komponentų galimo pakeitimo pasekmes. Jei stebint nustatoma, kad šie faktoriai pasikeitė ir jie kelia abejonių dėl NMP sveikumo, būtina atlikti naują produkto įvertinimą.
9. Mitybos faktoriai, turintys įtakos toksikologiniams bandymams su gyvūnais
9.1. Atliekant visapusišką įvertinimą, labai svarbu apgalvotai interpretuoti bet kokias neigiamas bandymų su gyvūnais pasekmes bei atskirti toksikologines ir mitybos požiūriu nesubalansuotos eksperimentinės dietos pasekmes. Vertinant NMP, būtina atsižvelgti ir į maistines bei toksikologines jo savybes. Išsamios žinios apie maistines NMP savybes (pvz., energinę vertę, baltymų sudėtį bei esamus mikroelementus) yra būtina sąlyga, atliekant toksikologinius bandymus. Rengiant bandymus su gyvūnais, maksimalus raciono komponento kiekis, kurį galima pasiekti, nesutrikdant maisto medžiagų balanso, turėtų atitikti didžiausią dozę tuo metu, kai tai turėtų būti palyginama su numanomu mažiausio kiekio poveikiu žmogui.
9.2. Jeigu numanomas vartojimo lygis yra aukštas, tradicinių maisto saugos rodiklių taikymas įvertinant produkto saugą gali sukelti sunkumų, rengiant įprastus gyvūnų maitinimo tyrimus su atitinkamomis dietomis, siekiant užsitikrinti aiškumą, susijusį su laukiamu žmonių vartojimo lygiu. Siekiant kompensuoti tai, kad nėra galimybės taikyti tinkamus ir racionalius saugos rodiklius, būtina poūmius ar lėtinius bandymus su gyvūnais papildyti medžiagų įsisavinimo ir apykaitos tyrimais su gyvūnais ir galiausiai su žmonėmis.
10. Toksikologiniai reikalavimai
10.1. Toksikologiniai NMP reikalavimai turi būti nustatomi atsižvelgiant į kiekvieną konkretų atvejį. Sprendžiant, ar reikia pateikti toksikologinius duomenis, galima atsižvelgti į tris scenarijus:
10.1.1. esminis lygiavertiškumas gali būti nustatytas vartojamam įprastam maistui ar maisto ingredientui, ir šiuo atveju tolesni tyrimai nereikalingi;
10.1.2. esminis lygiavertiškumas gali būti nustatytas NMP, išskyrus vieną ar kelias jo specifines savybes. Šiuo atveju tolesnis saugos įvertinimas turėtų remtis šių savybių tyrimu;
10.2. Jei įprastam produkto atitikmeniui esminio lygiavertiškumo negalima nustatyti, vertinant NMP įtaką sveikatai būtina atsižvelgti ne tik į jo tapatumą, cheminę sudėtį ar fizines bei chemines savybes, bet ir į tokius aspektus, kaip produkto šaltinis, sudėtis, galimas siūlomu bendruoju racionu pagrįstas vartojimas, poveikis ypač pažeidžiamoms gyventojų grupėms bei galimos perdirbimo pasekmės. Kuo maisto poveikis didesnis, tuo išsamesnius toksikologinius tyrimus reikia atlikti.
11. NMP poveikis žmonių mitybai
11.1. Visapusiškai įvertinant produktą, būtina atsižvelgti į jo poveikį mitybai esant ir įprastam (normaliam), ir maksimaliam vartojimui. Šis įvertinimas atliekamas remiantis išsamia atitinkamos literatūros analize, sudėties tyrimais, esminio lygiavertiškumo palyginimais ir prireikus gyvūnų modelinių tyrimų duomenimis. Jei prognozuojama, kad NMP atliks svarbų vaidmenį žmonių maisto racione, tai reikalingi atitinkami žmonių mitybos įvertinimo duomenys. Ypač reiktų atkreipti dėmesį į kūdikių, vaikų, nėščių ir krūtimi maitinančių moterų, pagyvenusių ir lėtinėmis ligomis sergančių (pvz., cukriniu diabetu ir malabsorbcija) žmonių grupių fiziolologines savybes ir medžiagų apykaitos reikalavimus.
11.2. Būtina informacija apie ilgalaikio ir trumpalaikio NMP vartojimo poveikį. Atitinkama informacija turėtų būti gauta atliekant bendrą mitybos ir jos poveikio priežiūrą, taip pat papildomai ištiriant poveikį produktų mitybinei kokybei (pvz., ilgalaikis riebalų pakaitalų poveikis riebaluose tirpstančių vitaminų apykaitai).
12. Maisto produktų gamyboje naudojami nauji mikroorganizmai
12.1. Mikroorganizmai gali būti naudojami kaip maisto gamintojai, maisto ingredientai ir maisto priedai. Daugelis jų seniai ir saugiai naudojami maisto fermentavimo procese. Fermentavimo metu jie arba žūva, arba suvartojami gyvi kartu su fermentuotu produktu.
12.2. Pagal apibrėžimą tradiciškai Lietuvoje maisto gamyboje nenaudoti mikroorganizmai negali turėti iš esmės ekvivalentiško atitikmens ir dėl to juos būtina įvertinti. Svarbūs tokie kriterijai: buvimas (pvz., būna kaip fermentatorius, kuris lieka gyvas ar žūva perdirbimo metu); galimybė apsigyventi žinduolių žarnyne; toksigeniškumo ar patogeniškumo žinduoliuose galimybė; ar buvo atliktas genetinis apdorojimas, ar ne. Jei naudojama genų inžinerija, svarbu atsižvelgti į šio priedo 27 punkte minimą galimą genetinės medžiagos perdavimą iš GMM.
12.3. Įvertinant GMM saugą, būtina atsižvelgti į naujai įvestos medžiagos kilmę, pvz., į vektorius, reguliavimo elementus, svetimus genus, įskaitant taikininius ir markerinius genus. Būtina atsižvelgti į du atvejus:
12.3.1. į homologinę sistemą (savęs klonavimo), kai visi genetiniai elementai gaunami iš tos pačios taksonominės rūšies,
12.4. Apskritai, tikslinga tirti segregalų ir horizontalų konstrukcijų stabilumą. Daugeliu atvejų galima taikyti esminio lygiavertiškumo sąvoką save klonavusiems organizmams. Heterologinėse sistemose būtina įvertinti gauto geno saugą, atsižvelgiant į jo pasekmes maistui bei naujo požymio poveikį maiste ir žarnyne esančio mikroorganizmo savybėms. Būtina ištirti ir įvertinti horizontalaus genų perdavimo žarnyne pasekmes.
13. Alergeninis potencialas
13.1. Būtina ištirti galimas alergines reakcijas į NMP esančius naujus baltymus ar kitus komponentus. Vadovaujantis bendraisiais vertinimo principais, būtina patikrinti in vitro ir in vivo imunologinę individų, kurie reaguoja į tradicinį maistą, reakciją į NMP. Tai gali sukelti etinių problemų, į kurias reikia atsižvelgti. Jei naujas baltymas yra išreikštas genais, gautais iš šaltinio, kuris žinomas kaip susijęs su alergija maistui, specifiniai imunologiniai tyrimai gali būti atlikti su žmonių, kurie yra alergiški šiam šaltiniui, serumu, pvz., Western Blotting arba radioalergosorbentinis (RAST) tyrimas. Jei in vitro analizė yra neigiama, galima atlikti in vivo odos testą arba klinikinį dvigubo aklo placebo poveikį žmonėms. Visi tyrimai turi atitikti pagrindinius reikalavimus ir etikos principus, išdėstytus geros klinikinės praktikos ir geros laboratorinės praktikos vadovuose.
13.2. Keletas faktorių gali būti galimo naujų baltymų alergeniškumo indikatoriais, pvz., epitopinės homologijos seka su žinomais alergenais, karščio stabilumas, jautrumas pH, žarnyno proteazių aktyvumas, plazmoje aptinkami kiekiai bei molekulių svoris. Papildomi įrodymai gali atsirasti dar prieš teikiant produktą į rinką, pasireiškiantys kaip darbuotojų sensibilizavimas.
14. Žymėtųjų genų įvertinimas
14.1. Žymėtieji genai naudojami kaip „uodegos“, siekiant nustatyti ir atrinkti tas augalų ir mikroorganizmų ląsteles, kurios buvo sėkmingai genetiškai pakeistos. Paprastai tikimasi, kad galutiniame NM produkte jie nebeatliks savo vaidmens. Šiuo metu dažniausiai augaluose naudojami žymėtieji genai – tai elementai, rodantys atsparumą antibiotikams bei herbicidams, kiti – atsparumą sunkiesiems metalams ar fenotipinei bei biocheminei atrankai. Žymėtųjų genų įvertinimo reikalavimai iš esmės yra panašūs į reikalavimus, taikomus bet kokių kitų svetimų genų saugai įvertinti.
14.2. Vertinant augalus, reikia atsižvelgti į:
14.3. Būtina įvertinti žymėtųjų genų, ypač tų, kurie rodo atsparumą antibiotikams, panaudojimą mikroorganizmuose, atsižvelgiant į šeimininko organizmą, nuo genų sandaros priklausančią biologinę sudėtį, galimybę, kad šie GMO apsigyvens žmogaus žarnyne, bei santykį tarp antimikrobinio veiksmingumo ir įgyto atsparumo.
14.4. Galima prognozuoti, kad patvirtintų žymėtųjų genų sąrašą galima parengti remiantis jų pirminio poveikio šeimininko organizmui įvertinimu. Jų antrinis poveikis šeimininko organizmui priklausys nuo keleto faktorių, tarp jų ir nuo jų įvedimo vietos į šeimininko DNR, ir čia kiekvienam atvejui reikalingas atskiras įvertinimas, nors nėra priežasties teigti, kad žymėtųjų genų antrinis poveikis gali būti didesnis nei kitų įvestų genų.
IV. NAUJŲ MAISTO PRODUKTŲ MOKSLINIS KLASIFIKAVIMAS, SIEKIANT ĮVERTINTI JŲ ĮTAKĄ SVEIKATAI
15. Šiose rekomendacijose terminas „augalai“ apima ir jūros dumblius. Terminas „gyvūnai“ apima ir žuvis bei vėžiagyvius, o terminas „mikroorganizmai“ apima bakterijas, grybus (taip pat ir mieles) bei mikroskopinius jūros dumblius (virusai ir plazmidės nepatenka į šių rekomendacijų taikymo sritį).
16. Į šios higienos normos taikymo sritį įeinantis maistas ir maisto ingredientai yra labai įvairūs. Siekiant palengvinti saugos ir mitybinį įvertinimą, NMP skirstomi į šešias grupes. Jos skiriasi savo sudėtingumu bei spręstinais klausimais.
16.1. I grupė. Grynosios cheminės medžiagos ar įprasti mišiniai, gauti iš genetiškai nemodifikuotų šaltinių
16.1.1. Į šią grupę įeina maisto produktai ir maisto komponentai, kurie yra atskiros chemiškai apibrėžiamos medžiagos ar jų mišiniai ir kurie buvo gauti ne iš genetiškai modifikuotų augalų, gyvūnų ar mikroorganizmų.
16.2. II grupė. Sudėtiniai NMP, gauti iš genetiškai nemodifikuotų šaltinių
16.2.1. Į šią grupę įeina sudėtiniai NMP, kurie nebuvo genetiškai modifikuoti arba kurie buvo gauti iš genetiškai nemodifikuotų šaltinių. Į šią grupę taip pat įeina augalai, gyvūnai ir mikroorganizmai, vartojami kaip maistas ar maisto komponentai (pvz., sudėtiniai angliavandeniai, riebalai, baltymai ar medžiagos, bendrai vadinamos skaidulinėmis medžiagomis).
16.3. III grupė. GM augalai ir jų produktai
16.3.1. GM augalus galima vartoti tiesiogiai kaip neapdorotą maistą arba juos perdirbus į maisto produktus ar maisto ingredientus, taip pat ir į grynas chemines medžiagas.
16.3.2. Šiai NMP grupei priskiriami visi šie maisto produktai ir maisto ingredientai (galima išskirti du pogrupius):
16.3.2.1. genetiškai modifikuotas augalas-šeimininkas, seniai vartojamas Lietuvoje maistui arba yra maisto šaltinis panašiomis paruošimo ir vartojimo sąlygomis;
16.4. IV grupė. GM gyvūnai ir jų produktai
16.4.1. GM gyvūnus galima vartoti tiesiogiai kaip neapdorotą maistą arba juos perdirbus į maisto produktus ar maisto ingredientus, taip pat ir į grynas chemines medžiagas. Iš GM gyvūnų pagamintus maisto produktus (pvz., kiaušinius, pieną) galima vartoti ir perdirbtus, ir neperdirbtus.
16.4.2. Šiai NMP grupei priskiriami visi šie maisto produktai ir maisto ingredientai (galima išskirti du pogrupius):
16.4.2.1. genetiškai modifikuotas gyvūnas-šeimininkas, kuris seniai vartojamas Lietuvoje maistui arba kaip maisto šaltinis panašiomis paruošimo ir vartojimo sąlygomis;
16.5. V grupė. GM mikroorganizmai ir jų produktai
16.5.1. Gyvus GM mikroorganizmus galima naudoti maisto ar maisto ingredientų gamyboje. Į šią grupę įeina visi NMP, kurie yra GM mikroorganizmai ar buvo pagaminti juos naudojant, neatsižvelgiant į tai, ar vartojamame NMP yra, ar nėra gyvų ląstelių.
16.5.2. Galima išskirti du pogrupius:
16.5.2.1. genetiškai modifikuotas mikroorganizmas-šeimininkas, kuris seniai vartojamas Lietuvoje maistui arba kaip maisto šaltinis panašiomis paruošimo ir vartojimo sąlygomis;
16.6. VI grupė. Maisto produktai, pagaminti naujais būdais
16.6.1. Šiai grupei priskiriami maisto produktai ir maisto ingredientai, kuriems buvo pritaikytas iki šiol maisto gamyboje nenaudotas procesas. Į naujus maisto gamybos procesus gali įeiti tokie procesai, kaip, pvz., naujas apdorojimo karščiu ar neterminis konservavimo būdas, naujas atšaldymo bei užšaldymo ar džiovinimo metodas, nauji fermentiniai procesai.
17. Šio priedo IV skyriuje minėtų grupių ir šioje normoje pateiktų kategorijų santykis trumpai aprašytas1 lentelėje.
1 lentelė. Naujų maisto produktų ir naujų maisto ingredientų klasifikacijos palyginimas su Maisto produktų mokslinio komiteto rekomendacijomis
|
|
Maisto produktų mokslinio komiteto NMP suskirstymas į grupes |
a* |
b* |
c* |
d* |
e* |
f* |
| I grupė |
Grynos cheminės medžiagos ar paprasti mišiniai iš genetiškai nemodifikuotų šaltinių |
|
|
x |
x |
x |
|
| II grupė |
Sudėtiniai NMP iš genetiškai nemodifikuotų šaltinių |
|
|
|
x |
x |
|
| III grupė |
Genetiškai modifikuoti augalai ir jų produktai |
X |
x |
|
|
|
|
| IV grupė |
Genetiškai modifikuoti gyvūnai ir jų produktai |
X |
x |
|
|
|
|
| V grupė |
Genetiškai modifikuoti mikroorganizmai ir jų produktai |
X |
x |
|
|
|
|
| VI grupė |
Maisto produktai, gauti naudojant naujus gavimo būdus |
|
|
|
|
|
x |
| * Lentelės a, b, c, d, e, f skilčių pavadinimai atitinka šios higienos normos 5.1 punkte (atitinkamai 5.1.1, 5.1.2, 5.1.3, 5.1.4, 5.1.5, 5.1.6) apibrėžtas naujų maisto produktų ir naujų maisto ingredientų kategorijas. |
|||||||
V. ESMINĖS INFORMACIJOS, REIKALINGOS ĮVERTINTI MAISTO PRODUKTŲ ĮTAKĄ SVEIKATAI, NUSTATYMAS
18. Siekiant nustatyti, kokia informacija yra būtina specifinių NMP grupių saugai įvertinti, šiame skirsnyje pateikiamos struktūrinės schemos. Pripažįstama, kad joks formalus metodas negali būti taikomas visiems NMP vienodai, todėl šios schemos pateikiamos tik kaip gairės. Būtina pateikti kitą informaciją, jei ji yra prieinama ar svarbi įvertinant NMP. Tačiau siūlymas neįtraukti informacijos, kurios reikalaujama pagal pateiktas schemas, turi būti moksliškai pagrįstas. Būtina pranešti apie bet kokius su maisto saugos įvertinimu susijusių tyrimų rezultatus.
19. Vertinant NMP, pagrindinis dėmesys skiriamas jo naujumui per se. Šiose rekomendacijose nekalbama apie cheminius ar mikrobiologinius NMP teršalus, kurie yra nesusiję su jo naujumu. Taip pat neatsižvelgiama į esančius mikrobų toksinus bei mikrobų ar virusų infekciją sukeliančius veiksnius, išskyrus atvejus, kai jie atsiranda dėl produkto naujumo.
20. Esminė informacija NMP saugai įvertinti nustatoma, vadovaujantis IV šio priedo skyriuje pateiktu suskirstymu į šešias grupes. Siekiant nustatyti, kokia struktūrine schema reikia vadovautis pateikiant informaciją dėl grupei ar pogrupiui priskirto NPM saugos ir mitybinės vertės, galima naudotis 2 lentele.
2 lentelė. Struktūrinių schemų indeksas, kuriuo reikia vadovautis, nustatant kiekvieną NMP grupę
|
|
Struktūrinė schema |
NMP grupė (pagal 1 priedo IV skyrių) |
||||||||||
| 1.1 |
1.2 |
2.1 |
2.2 |
3.1 |
3.2 |
4.1 |
4.2 |
5.1 |
5.2 |
6 |
||
| I |
NMP specifikacija |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| II |
Gamybos proceso įtaka NMP |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| III |
Organizmo, naudoto kaip NMP šaltinis, istorija |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| IV |
Genetinės modifikacijos poveikis šeimininko organizmui |
|
|
|
|
x |
x |
x |
x |
x |
x |
|
| V |
Genetinis GMO stabilumas |
|
|
|
|
x |
x |
x |
x |
x |
x |
|
| VI |
Naujos genetines medžiagos išraiškos specifiškumas |
|
|
|
|
x |
x |
x |
x |
x |
x |
|
| VII |
Genetinės medžiagos perdavimas iš GM mikroorganizmų |
|
|
|
|
x |
x |
x |
x |
x |
x |
|
| VIII |
Galimybės išlikti ir apsigyventi žmogaus žarnyne |
|
|
|
|
|
|
|
|
x |
x |
|
| IX |
Numatomi NMP vartojimo mastai |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| X |
Informacija apie ankstesnį NMP ar jo šaltinio poveikį žmogui |
x |
|
x |
|
x |
|
x |
|
x |
|
x |
| XXI |
Mitybinė NMP informacija |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| XXII |
Mikrobiologinė NMP informacija |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
| XXIII |
Toksikologinė NMP informacija |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
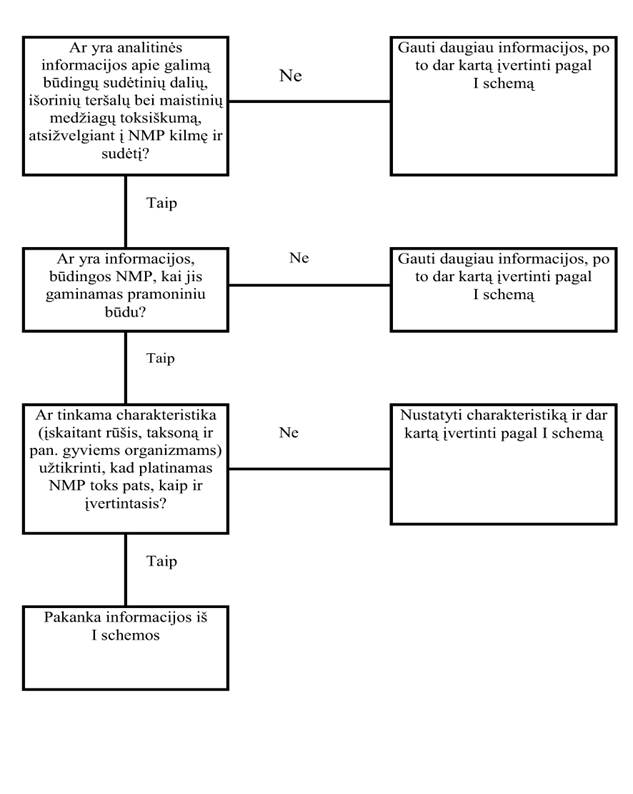
21. NMP charakteristika (I schema)
21.1. Siekiant užtikrinti tiriamo ir (ar) vertinamo bei į rinką teikiamo produkto tapatybę, reikalinga NMP kilmės ir sudėties charakteristika. Rengiant šią charakteristiką, reikia atsižvelgti į svarbiausius produkto saugą ir mitybinę vertę apibūdinančius parametrus. Šie parametrai aprėpia rūšis bei taksoną, taip pat cheminę sudėtį, kuri ypač susijusi su mitybinėmis produkto savybėmis bei galimais antimitybiniais ar toksikologiniais padariniais. Taksonominė tapatybė turėtų būti nustatyta pagal dokumentuose nurodytus ir tarptautiniu mastu priimtus principus, ir reiktų paaiškinti bet kokį nukrypimą nuo jų.
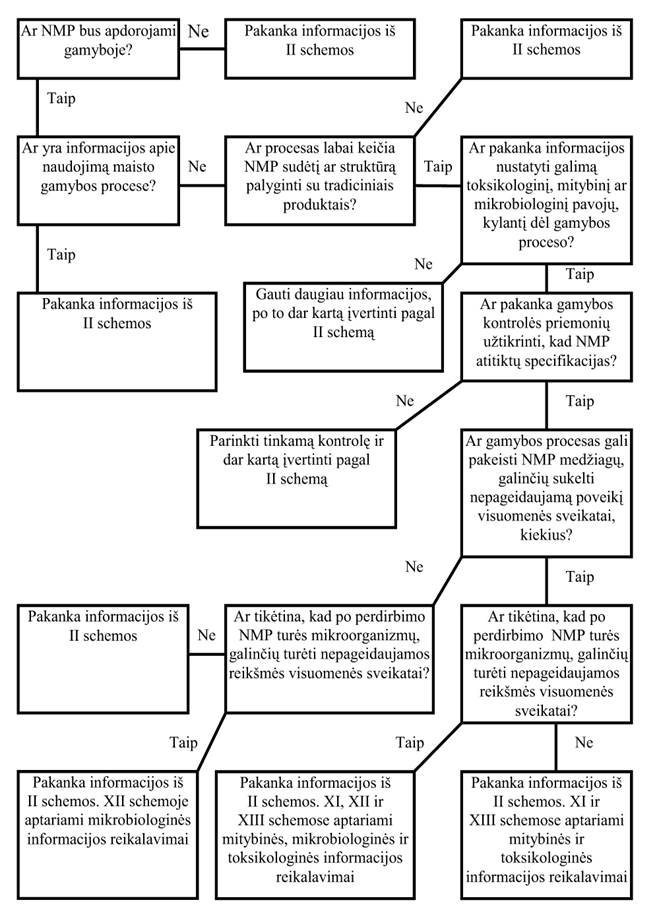
22. Gamybos proceso poveikis NMP (II schema)
22.1. Iš esmės ši schema taikoma visiems gamybos metu apdorotiems NMP. Reikia pateikti išsamų techninių detalių aprašymą, siekiant atskirti naujus ir esamus procesus bei numatyti, ar proceso metu atsiradę nauji maisto fiziniai, cheminiai ir (ar) biologiniai pokyčiai galėtų turėti įtakos galutinio produkto mitybiniams, toksikologiniams ir mikrobiologiniams parametrams.
22.2. Vertinant naujas technologijas, reikia atkreipti dėmesį į organinių ir neorganinių medžiagų likučius ar teršalus, kurie atsiranda dėl naujuose procesuose naudojamų prietaisų ir įrenginių bei cheminių, fizinių ar biologinių priemonių. Ypač svarbūs yra tie NMP gamybos proceso aspektai, kurie užtikrina, kad aprašyto proceso galutinis produktas atitinka I schemoje nurodomas charakteristikas.
22.3. Įvertinant naują produktą, į higieninius parametrus neatsižvelgiama, tačiau jiems taikomi Lietuvos higienos normos HN 15: 1998 „Maisto higiena“ reikalavimai [4.2].
22.4. Įvertinamas kiekvienas naujo proceso metu gautas maisto produktas. Galutinis įvertinimo tikslas – proceso įvertinimas platesne prasme, kad faktiškai nereikėtų tirti ir vertinti kiekvienos įmanomos produkto (proceso) kombinacijos. Tai reiškia platesnę strategiją – atitinkamų maisto grupių pavyzdžiai, gauti pritaikant naujus procesus, turėtų būti palyginami arba su neapdorotais atitikmenimis, arba su atitinkamais pavyzdžiais, kurie buvo perdirbti atitinkamu tradiciniu būdu.
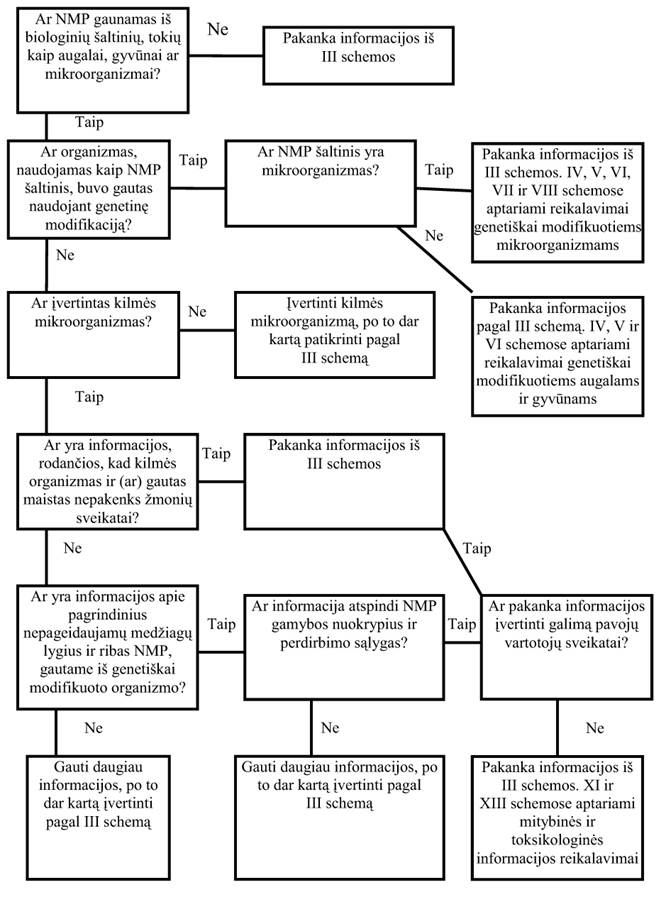
23. Organizmų, kurie buvo panaudoti kaip NMP šaltinis, aprašymas (III schema)
23.1. Maistinių augalų, gyvūnų ar mikroorganizmų naujumą lemia tai, kiek šie produktai yra nauji Lietuvos maisto rinkoje.
23.2. Jeigu, remiantis maisto raciono ataskaitomis, augalų, gyvūnų ar mikroorganizmų rūšys (taksonai) nei vienoje apskrityje paprastai nėra pripažintos kaip tinkamos maistui, ši rūšis (taksonas) laikoma nauja ir, siekiant nustatyti jos vaidmenį Lietuvos maisto rinkoje, būtina išsami jos charakteristika. Į ją turėtų įeiti informacija apie augalo, gyvūno ar mikroorganizmo ir jo produktų buvusį ir esamą vartojimą kitose pasaulio dalyse. Ši informacija taip pat turi aprėpti:
23.2.1. buvusius ir esamus žaliavų ir maisto gavimo būdus, pvz., auginant, nuimant derlių, skerdžiant ar sugaunant;
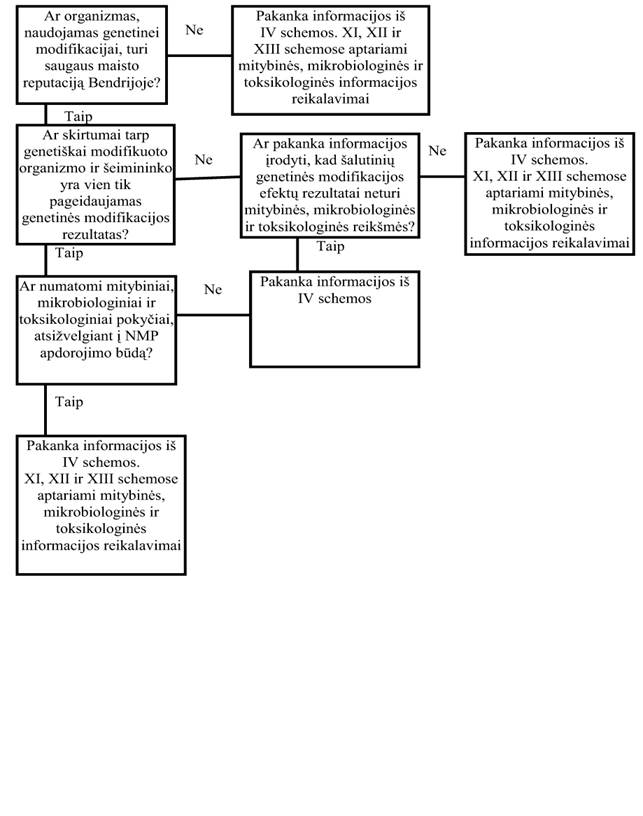
24. Genetinės modifikacijos poveikis šeimininko organizmo savybėms (IV schema)
24.1. Pagal šią schemą surinktoje informacijoje pagrindinis dėmesys skiriamas tam, kaip genetinė modifikacija veikia GMO savybes palyginti su šeimininko organizmu. Šis poveikis gali būti iš anksto numatytas ir nenumatytas. Pastaruoju atveju ypač reiktų atkreipti dėmesį į mitybinį, toksikologinį ir mikrobiologinį poveikį maisto produktams.
24.2. GM augalai
24.2.1. GM augalų ir jo produktų įvertinimo principai yra panašūs į tuos, kurie galioja genetiškai nemodifikuotiems augalams bei jų produktams. Įvertinti GM augalo saugą gali būti paprasčiau nei naują genetiškai nemodifikuotą augalą, jei genetiškai nemodifikuotas organizmas – tradicinis maistui vartojamas augalas, ir jis buvo pakeistas naudojant tiksliai apibrėžtus genetinės modifikacijos būdus. Šiuo atveju, vertinant saugą, pagrindinį dėmesį galima skirti genetinės modifikacijos rezultatams.
24.2.2. Jeigu dėl genetinės modifikacijos gaunamas naujas fenotipas, tai turėtų būti nustatytos ir ištirtos šio pakeitimo pasekmės augalo sudėčiai. Jei, pavyzdžiui, genetiškai modifikuotas augalas yra taip sukurtas, kad išreikštų natūraliai esančias insekticidines savybes, užkoduojant jį iš kito organizmo gautu genu, todėl jis ir tapo atsparus tam tikriems vabzdžiams kenkėjams, tai reikia nustatyti įterpto insekticidinio komponento toksikologines savybes. Cheminės sudėties modifikacijos saugą galima nustatyti standartiniais toksikologiniais tyrimais; taip pat turėtų būti įvertintas galimas alergeniškumas. Be to, reikia atsižvelgti ir į šalutinį poveikį. Šis įterpimas, pvz., savaiminė mutacija ar genominis pertvarkymas, turės įtakos bendram genetinės modifikacijos rezultatui. Labai svarbu turėti žinių apie normalią toksinų gamybą augale bei įvairių GM augalo auginimo ir kultūrinimo sąlygų poveikį jam, taip pat informaciją apie tai, ar naujas genų produktas atsiranda galutiniame maisto produkte.
24.2.3. Ta pati motyvacija taikoma svarbiems mitybiniams komponentams, ypač augaliniame maiste. Todėl pagrindiniai saugos įvertinimo komponentai yra šie:
24.2.3.2. genetinės modifikacijos kilmės charakteristika molekuliniame lygmenyje, įskaitant įterpimo vietą, kopijos numerį ir biocheminės išraiškos lygį;
24.2.3.3. jei įmanoma, parentalinio maistinio organizmo ir jo naujo darinio esminio lygiavertiškumo nustatymas, atliekant cheminę ir fenotipinę analizę;
24.2.3.4. jei esminio lygiavertiškumo nustatyti neįmanoma, atliekami įprastiniai saugos tyrimai su specifinėmis maiste dėl fenotipinių pokyčių atsiradusiomis cheminėmis medžiagomis, įtraukiant arba naujo geno naująjį produktą, arba natūralių toksinų, kurių dabar yra maiste pasikeitęs kiekis, saugą. Reikia atkreipti dėmesį ir į potencialų naujų komponentų alergeniškumą.
24.3. GM gyvūnai
GM gyvūnams taip pat taikomi bendrieji GM augalų saugos įvertinimo principai. Pradinėje stadijoje sauga įvertinama, nustatant parentalinio maistinio organizmo ir GM organizmo esminį lygiavertiškumą, pagrindinį dėmesį skiriant pirminėms ir antrinėms genetinės modifikacijos proceso pasekmėms. Pavyzdžiui, jeigu modifikacija siekiama karvės pieno globulinus pakeisti „žmogiškesniais“, tai naujuosius globulinus būtina įvertinti. Kitas pavyzdys – žuvis, kuri genetiškai pakeista taip, kad gamintų nešąlantį baltymą. Šios cheminės modifikacijos saugą galima įvertinti naudojantis įprastais toksikologiniais metodais bei atsižvelgiant į alergeniškumo aspektus.
24.4. GM mikroorganizmai
Laikantis dėl GM augalų ir GM gyvūnų priimtų nuostatų ir siekiant supaprastinti procedūrą, parentalinis mikroorganizmas, būdamas genetinės modifikacijos subjektu, a priori turi būti pripažintas arba kaip nepatogeniškas, biologiškai naudingas žmogaus žarnyno mikroflorai mikroorganizmas, tradiciškai naudojamas Lietuvoje maisto fermentacijos procesuose, arba kaip tradiciškai maisto, maisto priedų bei perdirbimo priemonių gamyboje naudojamas organizmas. Kitais atvejais reikia įvertinti ne tik genetinės modifikacijos, bet ir parentalinio organizmo naujumą.
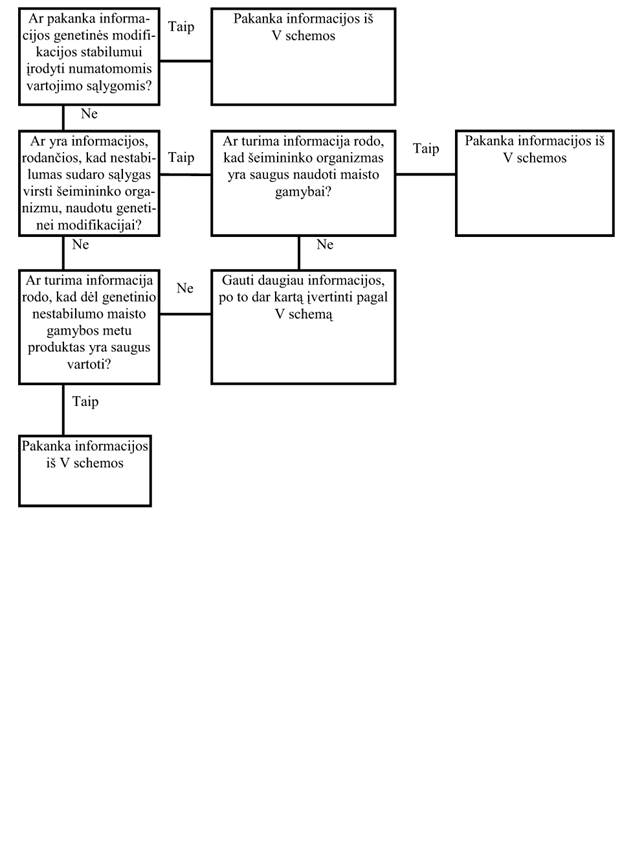
25. GMO, naudojamų kaip NMP šaltinis, genetinis stabilumas (V schema)
Genetinio stabilumo klausimas yra susijęs su įterptos genetinės medžiagos struktūros ir vietos išlaikymu bei genų išraiška GMO.
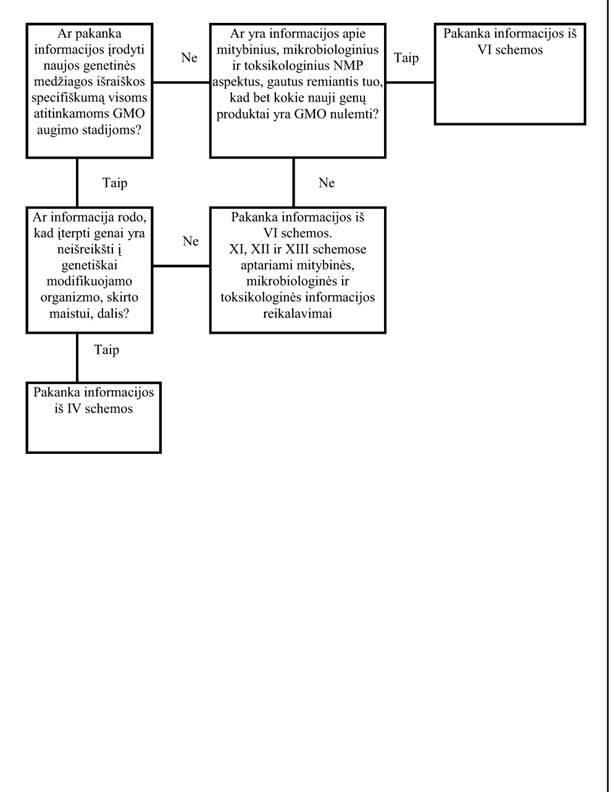
26. Naujos genetinės medžiagos išraiškos specifika (VI schema)
Ši schema susijusi su faktoriais, reguliuojančiais genų išraišką, pavyzdžiui, organo/audinio specifika, slopinimo ir aktyvacijos sąlygomis.
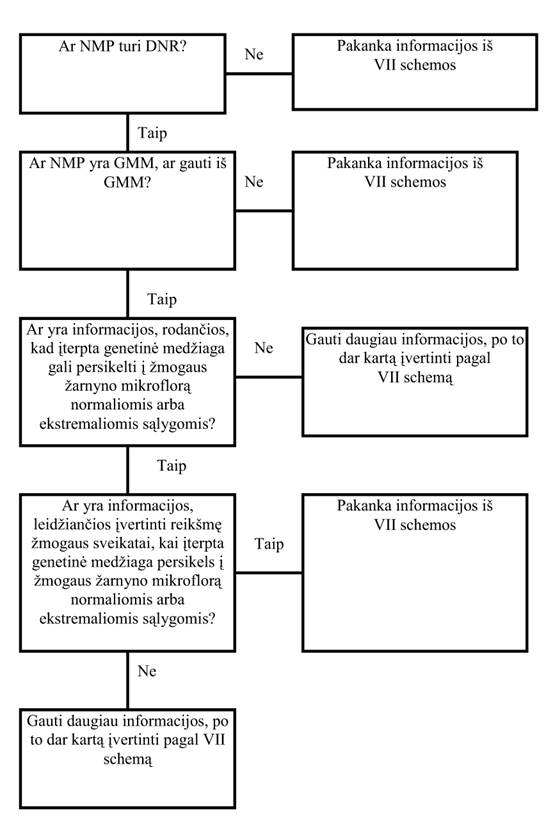
27. Genetinės medžiagos perkėlimas iš GMO (VII schema)
27.1. Remiantis turimomis žiniomis, tiriant genų perėjimą žmogaus žarnyne iš GMO, pagrindinis dėmesys skiriamas mikroorganizmams. Horizontalus genų perėjimas tarp mikroorganizmų yra gerai ištirtas ir dėl to, įvertinant maisto saugą, reikia į jį atsižvelgti. Vienas biologinio buvimo aspektų yra galimas genetinės medžiagos perkėlimas iš GMO į žmogaus žarnyno mikroflorą. Šiam aspektui nustatyti yra keletas skirtingų modelių, pvz., atliekant bandymus gyvūnų žarnynuose ir in vitro.
27.2. Įvertinant genų perėjimo pasekmes maisto saugai, reikėtų atsižvelgti į modifikuotuose žarnyno mikroorganizmuose esančio geno ir jo produkto kilmę, perėjimo dažnumą ir išraiškos lygį. Teoriškai galimas genų perėjimas iš augalų į mikroorganizmus – reiktų atkreipti dėmesį į tokio perėjimo pasekmes.
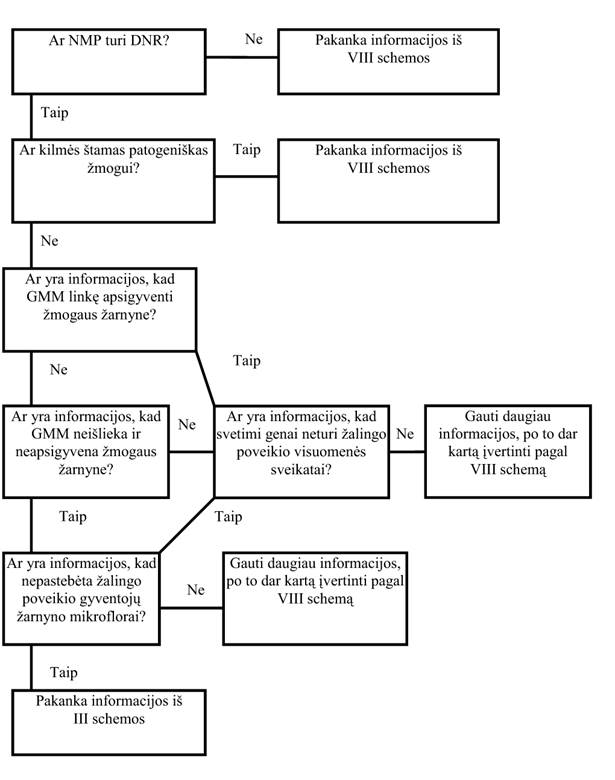
28. Genetiškai modifikuotos medžiagos (GMM) sugebėjimas išlikti ir apsigyventi žmogaus žarnyne (VIII schema)
28.1. Genetinė modifikacija gali paskatinti GMM išlikimą perėjimo per žarnas metu bei jos apsigyvenimą žmogaus žarnyne. Gali atsirasti antagonistinis ir sinergistinis poveikis žarnyno floros sudėčiai, o tai gali turėti įtakos žmogaus sveikatai. Dėl to būtini eksperimentiniai duomenys apie atitinkamas GMO savybes.
28.2. Jei maiste yra gyvų GMO, ypač didelį dėmesį reiktų skirti jų sugebėjimui išlikti bei apsigyventi žmogaus virškinimo trakte ir išlaikyti savo genominį stabilumą. Siekiant tai nustatyti, gali prireikti in vitro ir in vivo žarnyno modelių, kurie kiek galima tiksliau atkartotų žmogaus modelį. Ypač reikia atsižvelgti į aspektus, susijusius su patogeniškumu ir virškinimo trakto imunitetu.
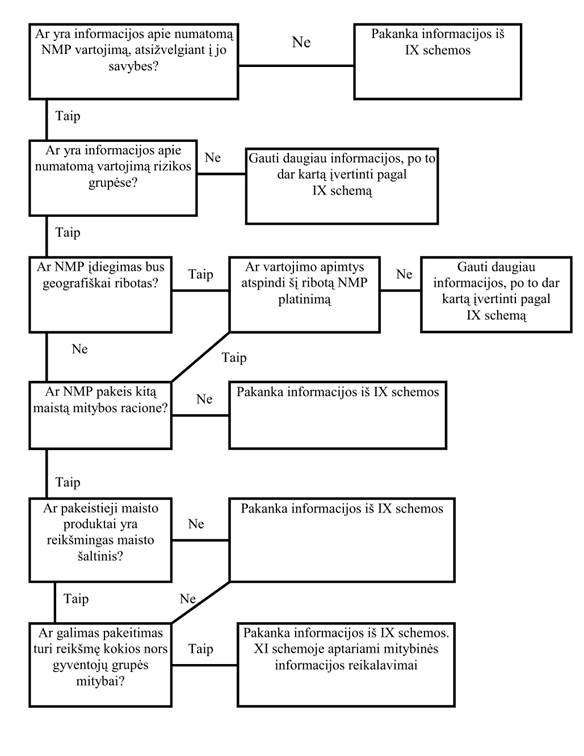
29. Numanomas NMP suvartojimas ir vartojimo intensyvumas (IX schema)
Siekiant įvertinti NMP dietinę ir mitybinę reikšmę, reikia numatyti jo galimą suvartojimą. Šis įvertinimas bus pagrįstas informacija apie NMP kilmę bei jo numatomu suvartojimu, atsižvelgiant į jo savybes, pvz., galimybę pakeisti riebalus.
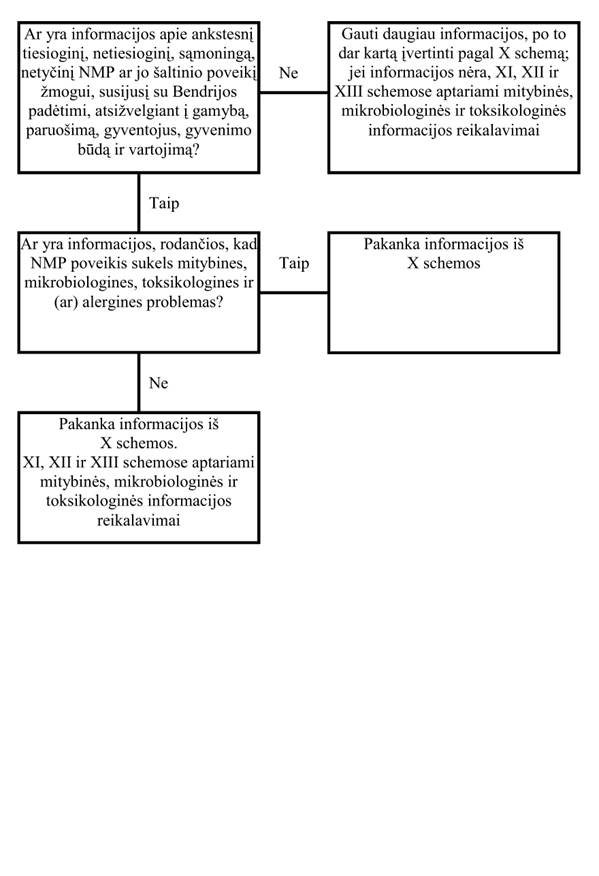
30. Informacija apie anksčiau vartotus NMP ar jų šaltinius bei jų poveikį žmogui (X schema)
Siekiant nustatyti įvertinimo kriterijus, labai svarbu turėti dokumentus, susijusius su buvusiu NMP šaltinio vartojimu Bendrijoje ar NMP šaltinio ir (arba) NMP vartojimu kitose pasaulio dalyse. Tačiau vien maisto vartojimo istorija Bendrijai nepriklausančiose šalyse negarantuoja, kad NMP gali būti saugiai vartojamas Bendrijoje. Informacijoje turėtų būti pateikti tokie aspektai, kurie parodytų, kad tradicinis augalo, gyvūno ar mikroorganizmo apdorojimas ir paruošimas užkerta kelią jų netinkamam vartojimui bei trumpalaikiam ir ilgalaikiam poveikiui žmogaus sveikatai, pavyzdžiui, NPM esančių antimitybinių (toksinių) faktorių įtakai. Daugeliu atveju atsargumo priemonės atsispindi atitinkamuose vietiniuose ir kultūriniuose papročiuose.
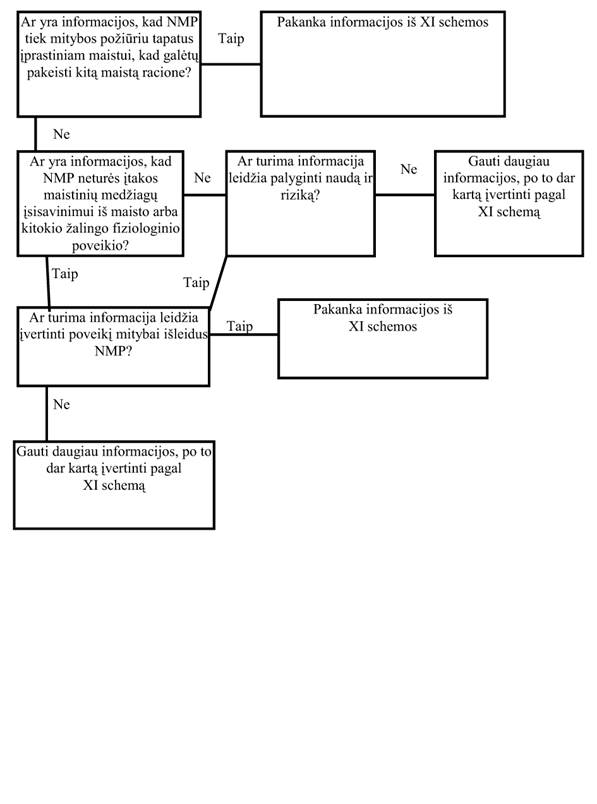
31. Mitybinė informacija apie NMP (XI schema)
31.1. Kaip jau pirmiau minėta, įvairiapusiškas įvertinimas turėtų aprėpti sistemingą NMP sudėties, paruošimo peržiūrėjimą ir jų prognozuojamą vaidmenį maisto racione. Toks įvertinimas kartu su atitinkamos išleistos medžiagos apžvalga leistų nustatyti esminį NMP lygiavertiškumą su tradiciniu maistu ar maisto komponentu.
31.2. Jei esminio lygiavertiškumo nustatyti negalima, siekiant įvertinti kai kuriuos mitybos kokybinius aspektus, reiktų atlikti atitinkamą pirminį įvertinimą modeliuose su gyvūnais, tačiau išsamų mitybinį įvertinimą reikia atlikti modeliuose su žmonėmis. Tokie tyrimai turėtų būti pagrįsti tiksliai apibrėžtomis hipotezėmis, kurios numatytų aiškius mitybos ir medžiagų apykaitos rezultatus, susijusius su NMP vartojimu, jo dietinėmis savybėmis bei numanoma vartotojų grupe.
31.3. Mitybos pasekmes reiktų įvertinti, kai turimas normalus ir maksimalus vartojimas, o pateikiant duomenis apie maistinių medžiagų sudėtį, reiktų atsižvelgti į sandėliavimo, tolesnio perdirbimo ir virimo poveikį. Taip pat turėtų būti įvertintas antimitybinių faktorių poveikis (pvz., mineralinių medžiagų įsisavinimo slopinimas ar biologinis priimtinumas) viso raciono mitybinei vertei.
31.4. Tiriamųjų objektų skaičius turėtų būti pakankamas, kad tyrimas būtų statistiškai vertingas. Visi tyrimai turėtų atitikti geros klinikinės ir geros laboratorinės praktikos reikalavimus ir etikos principus.
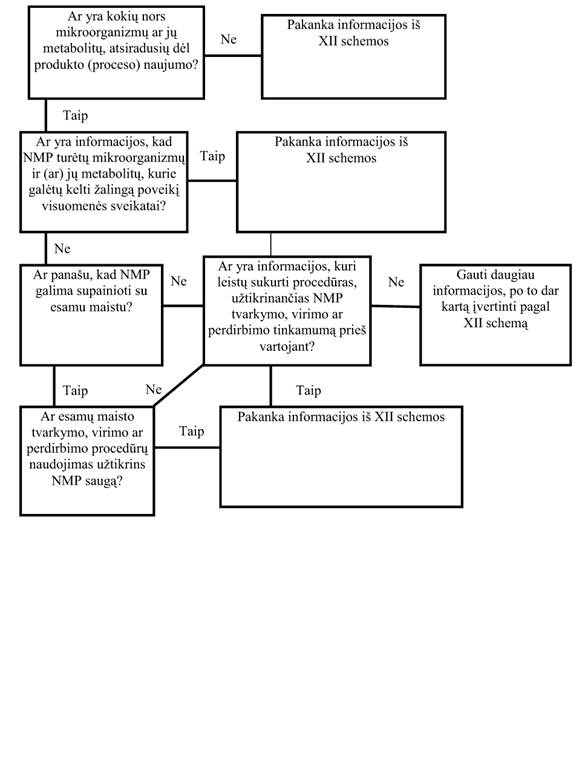
32. Mikrobiologinė informacija apie NMP (XII schema)
Be toksikologinės ir mitybinės saugos, į saugaus NMP sampratą įeina ir mikrobiologinė sauga. Paprastai sąmoningai naudojamas NMP organizmas – šaltinis turi būti pripažintas nepatogenišku ir netoksigenišku mikroorganizmu, kurio genetinis stabilumas yra žinomas ir neturi įtakos pageidaujamoms normalios virškinimo trakto floros savybėms. Į NMP tyrimus turėtų būti įtraukta ir esamų mikroorganizmų charakteristika bei jų metabolitų analizė.
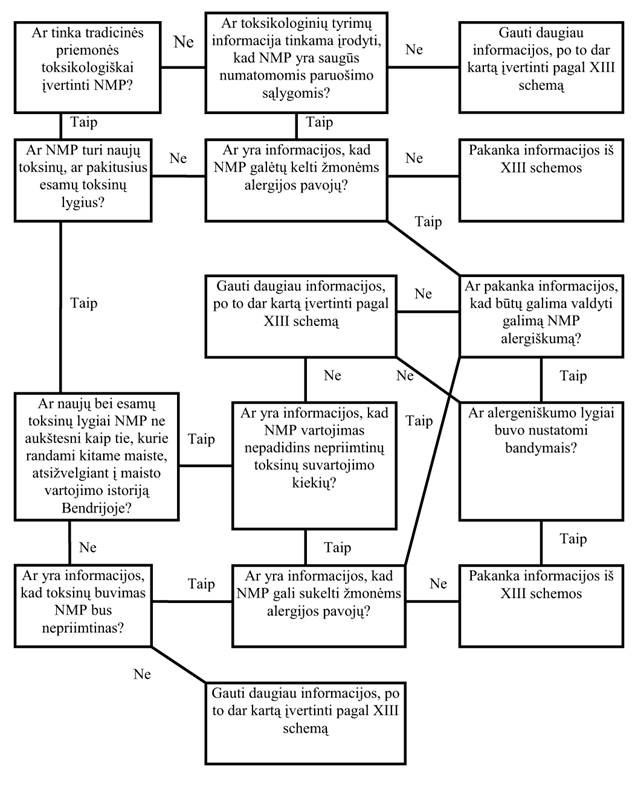
33. Toksikologinė informacija apie NMP (XIII schema)
33.1. Būtina toksikologinė informacija NMP įvertinti pateikiama pagal duotą schemą. Ši schema gali būti taikoma maisto produktams, kuriems gali būti nustatytas esminis lygiavertiškumas, bei maistui, kuriam jis negali būti nustatytas, ir dėl to šiems produktams būtina atitinkama mitybinių ir toksikologinių tyrimų programa.
33.2. Jeigu esminis lygiavertiškumas tradiciniam atitikmeniui negali būti nustatytas, kiekvienu atveju vertinant NPM saugą būtina atsižvelgti į šiuos aspektus:
33.2.2. toksiškumo tyrimus in vitro bei in vivo, įskaitant mutageniškumo, reprodukcinius, teratogeniškumo bei ilgalaikius mitybos tyrimus, kurie atliekami pagal nustatytą eiliškumą kiekvienam atskiram atvejui;
33.3. Naujų sudėtinių mikrodalelių ir izoliuotų naujų maisto komponentų, kurie nuo tradicinio maisto skiriasi aiškiai matomomis charakteristikomis, arba nustatytų naujų produktų, kurie gauti iš GMO, atvejais tyrimus galima atlikti ne su visu NMP, o apsiriboti tiktai tais produktais ar medžiagomis. Kai kuriais atvejais, tiriant naują savybę, nustatoma, kad jos mitybinis poveikis laboratoriniams gyvūnams yra tik dalinis, taigi nustatant NMP saugą gali būti taikomas tradicinis toksikologinis metodas.
33.4. Didžiosios dalies cheminių medžiagų, panašiai kaip ir maisto priedų, saugą tikriausiai galima ištirti naudojantis įprastais saugos įvertinimo metodais, kurie aprašyti Maisto produktų mokslinio komiteto 10 ataskaitoje. Tai reiškia, kad tradicinės toksikologinės tyrimo procedūros taikomos pagal nustatytą eiliškumą. Į tai turėtų būti įtraukti graužikų mutageniškumo bei atitinkami maitinimo tyrimai, ypač išsamiai atliekant visų toksikologinių parametrų tyrimus. Be to, jei reikalauja struktūros ar poveikio veiksniai, reiktų atlikti papildomus tyrimus, atsižvelgiant į visas įprastas toksikologines pasekmes, tarp jų į medžiagų apykaitą, toksikokinetiką, lėtinį toksiškumą bei kancerogeniškumą, reprodukcinę funkciją, teratogeniškumą ir galbūt neurotoksiškumą bei imunotoksiškumą.
33.5. Naujoms sudėtinėms makrodalims ar NMP, kurie nėra iš esmės lygiaverčiai tradiciniams atitikmenims, būtina tyrimų programa, atsižvelgianti į toksikologinius aspektus. Į šią programą turėtų būti įtraukti mažiausiai 90 dienų trukmės graužikų mitybos tyrimai, ypač atkreipiant dėmesį į dozių parinkimą ir vengiant mitybos nesubalansuotumo problemų. Atsižvelgiant į šiuos apribojimus, toksikologinius tyrimus bei jų interpretaciją gali tekti atlikti kitais būdais (1 priedo 9 punktas).
33.6. Reikia ištirti mutageniškumo galimybes. Atliekant bet kokius mutageniškumo tyrimus in vitro, reikės atsižvelgti į įprastas pasekmes. Tiriant naujas sudėtines makrodalis in vitro mutageniškumo tyrimo sistemose, galima susidurti su specialiomis techninėmis problemomis, ypač dėl NMP ar jo sudėtinių dalių poveikio augimo terpei, tiriamosioms ląstelėms ar tiriamiesiems organizmams, kurie nesusiję su mutageniškumu. Gali būti tokie atvejai, kai reikalingi maitinimo tyrimai kitoms organizmų rūšims bei poveikio tyrimas virškinimo trakto floros sudėčiai. Taip pat reikia ištirti alergeniškumo galimybes.
VI. REKOMENDACIJŲ PERŽIŪRĖJIMAS
34. Naujų maisto produktų srityje pastebima sparti raida. Mokslas ir technologijos daro didelę pažangą. Daugelis valstybių ir tarptautinių organizacijų tobulina naujų maisto produktų įvertinimo procedūras bei pagrindines kryptis. Šios rekomendacijos taip pat bus peržiūrimos, atsižvelgiant į jų įgyvendinimo patirtį ir naujus šios srities mokslo laimėjimus.
______________
2 priedas
REKOMENDACIJOS DĖL INFORMACIJOS, KURIĄ BŪTINA PRIDĖTI PRIE PRAŠYMO, SIEKIANT NAUJUS MAISTO PRODUKTUS IR NAUJUS MAISTO INGREDIENTUS TEIKTI RINKAI, PATEIKIMO MOKSLINIŲ ASPEKTŲ
I. ĮVADAS
1. 1 priede išdėstytos rekomendacijos dėl naujų maisto produktų įvertinimo rekomendacijos dėl naujų maisto produktų bei naujų maisto ingredientų (NMP) informacijos, kurią būtina pridėti prie prašymo dėl šių produktų pateikimo rinkai, mokslinių aspektų. Šioje dalyje pateikiama rekomendacijų dėl mokslinių šios informacijos pateikimo aspektų santrauka. Tokia bendra prašymų struktūra palengvins jų mokslinį įvertinimą.
II. BENDROJI SCHEMA
2. 1 priede buvo pabrėžta, kad visiems NMP negali būti vienodai taikomas vienas formalus metodas. Todėl čia pateiktomis schemomis galima naudotis kaip gairėmis, o ne kaip griežtais nurodymais, tačiau prašyme dėl NMP teikimo rinkai turėtų atsispindėti šių rekomendacijų esminės filosofinės gairės ir pagrindiniai pricipai. Žemiau pateikta schema parodo loginę seką.
Bendras NMP aprašymas, įtraukiant techninius duomenis ir skirstymą į grupes, kaip nurodyta šios higienos normos 5.1 punkte
â
NMP įtraukimas į vieną iš Maisto produktų mokslinio komiteto nurodytų grupių (pogrupių)
â
Pagrindinių informacijos reikalavimų nustatymas
â
Derinimas su struktūrinėmis schemomis bei reikalaujamų duomenų pateikimas
â
Pareiškėjo įvertinimas ir išvados
III. INFORMACIJOS PAKETAS
3. Pareiškėjas turėtų pateikti informacijos paketą žemiau nurodyta tvarka:
3.1. Administraciniai duomenys
Šioje dalyje pateiktoje informacijoje turėtų būti pareiškėjo, NMP gamintojo bei asmens, atsakingo už informacijos paketo pateikimą, vardas, pavardė (pavadinimas) ir adresas.
3.2. Bendrasis aprašymas
3.2.1. Siekiant užtikrinti, kad maistas ar maisto produktas, skirtas teikti rinkai, įeitų į šios higienos normos dėl naujų maisto produktų ir naujų maisto ingredientų taikymo sritį, turėtų būti pateikti duomenys, kad pagal higienos normos 5.1 punktą NMP būtų galima suskirstyti į grupes.
3.2.2. Siekiant palengvinti įvertinimo procedūrą, Maisto produktų mokslinis komitetas perklasifikavo įstatymuose suskirstytas įvairias grupes pagal jų panašumą saugos požiūriu. 1 priedo IV skyriuje nustatytos šešios stambesnės grupės ir atitinkami pogrupiai. NMP turėtų būti priskirtas vienai iš šių grupių (pogrupių) (1 priedo 1 lentelės I dalis); toks suskirstymas turėtų būti moksliškai pagrįstas.
3.3. Pagrindinių informacijos reikalavimų nustatymas
Siekiant nustatyti, kuri iš I-XIII schemos yra būtina pateikiant duomenis, leidžiančius įvertinti NMP saugą ir atlikti jo mitybinį įvertinimą, reikia naudotis 1 priedo 2 lentele.
3.4. Vadovavimasis struktūrinėmis schemomis
3.4.1. Renkant būtinus duomenis, reikia vadovautis 1 priede pateiktomis detaliomis I-XIII schemomis. Vadovaujantis šiomis schemomis, atsakoma į jos klausimus ir tai padeda nuspręsti, ar pareiškėjui pakanka prieinamų duomenų, ar jų reikia ieškoti ir dar kartą įvertinti papildomą informaciją.
3.5. Pareiškėjo įvertinimas ir išvados
Reikia pateikti pareiškėjo išvadas dėl pagrindinių su NMP susijusių klausimų (1 priedo III skyrius), kurias jis padaro įvertinęs visą surinktą informaciją.
3 priedas
REKOMENDACIJOS DĖL PIRMINIO ĮVERTINIMO ATASKAITŲ, SUSIJUSIŲ SU PRAŠYMAIS DĖL NAUJŲ MAISTO PRODUKTŲ IR NAUJŲ MAISTO INGREDIENTŲ TEIKIMO RINKAI, PARENGIMO MOKSLINIŲ ASPEKTŲ
I. ĮVADAS
1. Šioje higienos normoje nustatyta, kad asmuo, atsakingas už produkto teikimą rinkai pirmą kartą, turi pateikti prašymą RMC, kuris turi parengti pirminio įvertinimo ataskaitą.
2. Tam tikros patirties įgyta taikant įvairių nacionalinių ir tarptautinių įstaigų bei valdžios institucijų naujų maisto produktų saugą įvertinančias procedūras. Praktiniais tikslais reikia pasiekti, kad įvairių nacionalinių valdžios institucijų įvertinimus būtų galima palyginti, o mokslinio įvertinimo ataskaitų struktūra būtų vienoda. 1 priede bei kitur pateikti išsamūs reikalavimai dėl kiekvienos specifinės NMP rūšies, pvz., dėl genetiškai modifikuotų produktų ar dėl kitų naujų baltymų šaltinių. Specifinės saugos rekomendacijos nėra pateiktos kiekvienai NMP grupei ir remiantis turimomis žiniomis dabar to padaryti negalima. Kiekvieno atskiro atvejo tyrimas užtikrina, kad į naujai atsiradusią riziką tinkamai reaguojama.
II. PIRMINĖS ĮVERTINIMO ATASKAITOS STRUKTŪRA
4. Pirminio įvertinimo ataskaitas reikėtų rengti tokiais trimis etapais:
4.1. Patikrinti, ar prašymas iki galo užbaigtas ir pateiktas pagal 2 priedą.
Pirminėje įvertinimo ataskaitoje turi būti pateiktas patvirtinimas, kad į prašymą yra įtraukti atitinkami administraciniai ir techniniai duomenys, kurie pateikti 2 priede nurodyta tvarka, bei pateikta 1 priedo V skyriuje ir 21 punkte nurodyta informacija. Jei pateikti duomenys skiriasi nuo tų, kurių reikalaujama 2 priede, arba jie pateikti ne ta tvarka, pareiškėjo paaiškinimas turėtų būti peržiūrėtas.
4.2. Nustatyti, ar pareiškėjas tinkamai interpretavo bei įvertino pateiktus duomenis.
Reikia nustatyti ir pateikti nuomonę, ar pareiškėjas tinkamai interpretavo bei įvertino pateiktus duomenis. Jeigu RMC ir pareiškėjai nesutaria dėl interpretavimo ir įvertinimo, įvertinimo ataskaitoje turėtų būti pateiktos išsamios nesutarimų priežastys.
4.2.1. Esminis lygiavertiškumas
Norint įvertinti, būtina pateikti galutinio produkto palyginimą su produktu, atitinkančiu nustatytus saugos reikalavimus. Todėl pirminėje įvertinimo ataskaitoje turi būti pateikta kompetentingos institucijos nuomonė dėl pareiškėjo pateiktos charakteristikos, susijusios su esminiu lygiavertiškumu.
4.2.1.1. Vertinant, ar NMP yra iš esmės lygiavertis tradiciniam atitikmeniui, reikia vadovautis 1 priedo 6 punkte pateiktu esminio lygiavertiškumo kriterijumi. Jei nustatyta, kad NMP yra iš esmės lygiavertis tradiciniam atitikmeniui, jis gali būti laikomas sveiku ir toksikologijos bei mitybos požiūriu tinkamu naudoti bendrame maisto racione panašiai kaip jo atitikmuo ar kaip atitikmens pakaitalas. Sprendžiant apie NMP esminį lygiavertiškumą jo atitikmeniui, reiktų atsižvelgti į bet kurio įprasto produkto žinomą ir išmatuojamą natūralią įvairovę.
4.2.1.2. Jei nustatoma, kad NMP yra iš esmės lygiavertis tradiciniam atitikmeniui, išskyrus vieną ar kelias apibrėžtas savybes, pagrindinį dėmesį reikia skirti šioms savybėms įvertinti. Jos turi būti vertinamos kiekvienu atveju atskirai ir kai kuriais atvejais gali prireikti duomenų, atitinkančių tuos, kurie reikalingi įvertinant maisto priedų saugą.
4.2.2. Vertinant iš esmės lygiaverčius maisto produktus nereikia jokių papildomų duomenų. Kitus NMP būtina toliau vertinti. Vertinimas gali būti susijęs su specifinėmis apibrėžtomis savybėmis arba su visu NMP. Prašyme pateiktą informaciją reikia vertinti atsižvelgiant į NMP kilmę, pagaminimo būdą bei jo sudėtį, taip pat ir jo vaidmenį didžiosios visuomenės dalies, o ypač specifinių visuomenės grupių, maisto racione.
4.2.2.1. Mitybos įvertinimas
Ypatingą dėmesį reiktų atkreipti į prognozuojamą NMP vartojimo lygį bei jo galimą mitybinį poveikį (1 priedas, 11 ir 30 punktai). Pavyzdžiui, reikia patikrinti, ar buvo įvertintas specifinių gyventojų grupių NMP suvartojimo poveikis bendram maistinių medžiagų, kurioms buvo nustatyti faktiškai gyventojų vartojami kiekiai arba „leidžiamas suvartojimo lygis“, racionui. Kompetentinga institucija turi įvertinti dokumentus, remdamasi gyvūnų modeliais ir žmonių medžiagų apykaitos tyrimais, įskaitant tyrimus klinikose. Reikia atsižvelgti ir į ilgalaikį, ir į trumpalaikį NMP poveikį žmonių mitybai. Reikia atkreipti dėmesį į netikėtą žalingo poveikio pasireiškimą kitiems maisto raciono komponentams ir į pokyčius atitinkamuose biomarkeriuose.
4.2.2.2. Naujų mikroorganizmų, skirtų vartoti maistui, įvertinimas
RMC atliktas tyrimas turi patvirtinti, kad prašyme dėl NMP, turinčio gyvų mikroorganizmų, pateikta atitinkama informacija apie jų saugų vartojimą. Mikroorganizmų duomenys turi būti pateikti taip, kad galima būtų juos suskirstyti pagal esminio lygiavertiškumo principą (1 priedas).
4.2.2.3. Toksiškumo ir alergeniškumo įvertinimas
Prireikus būtina įvertinti duomenis, susijusius su apibrėžtų NMP savybių ar viso NMP toksiškumu ir alergeniškumu. 1 priedo 10, 13, 33 punktuose nurodyta informacija reikalinga įvertinti NMP įtaką sveikatai. Prašyme pateikti duomenys turėtų būti ištirti ir pateikta nuomonė.
4.3. Įvertinti pateiktus duomenis, santrauką, išvadas ir rekomendacijas.
Įvertinimo ataskaitoje turi būti pateikta išvada apie pateiktų duomenų tinkamumą ir užbaigtumą. RMC parengia ataskaitos santrauką. Prie įvertinimo ataskaitos pridedamos išvados bei rekomendacijos dėl teikimo į rinką sąlygų. Išvadoje taip pat pateikiama pareiškėjo nurodyta NMP nauda bei trūkumai.
______________
4 priedas
TARYBOS IR KOMISIJOS DIREKTYVŲ DĖL VALSTYBIŲ NARIŲ ĮSTATYMŲ, TAIKOMŲ NAUJIEMS MAISTO PRODUKTAMS IR NAUJIEMS MAISTO INGREDIENTAMS, SUVIENODINIMO, SU KURIŲ NUOSTATOMIS SUDERINTA LIETUVOS HIGIENOS NORMA „HN 106:2001 NAUJI MAISTO PRODUKTAI“, SĄRAŠAS
1. Europos Parlamento ir Tarybos Reglamentas 258/97/EB dėl naujų maisto produktų ir naujų maisto ingredientų.
2. 1997 m. liepos 29 d. Komisijos rekomendacija Nr. 97/618/EB dėl naujų maisto produktų ir naujų maisto ingredientų informacijos, kurią būtina pridėti prie prašymo, siekiant šiuos produktus teikti rinkai, mokslinių aspektų bei pateikimo ir dėl pirminio įvertinimo ataskaitų parengimo pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 258/97.
3. 2000 m. sausio 10 d. Komisijos reglamentas (EB) Nr. 50/2000 dėl maisto produktų ar maisto ingredientų, savo sudėtyje turinčių maisto priedų ar kvapiųjų medžiagų, kurios buvo genetiškai modifikuotos ar pagamintos iš genetiškai modifikuotų organizmų, ženklinimo.
4. 1998 m. gegužės 26 d. Tarybos reglamentas (EB) 1139/98 dėl informacijos, nenurodytos Direktyvoje 79/112/EEB, privalomo pateikimo ženklinant tam tikrus maisto produktus, pagamintus iš genetiškai modifikuotų organizmų.
5. 2000 m. sausio 10 d. Komisijos reglamentas (EB) Nr. 49/2000, papildantis Tarybos reglamentą (EB) Nr. 1139/98 dėl informacijos, nenurodytos Direktyvoje 79/112/EEB, privalomo pateikimo ženklinant tam tikrus maisto produktus, pagamintus iš genetiškai modifikuotų organizmų.
6. Regulation (EC) No 258/97 of the European Parliament and of the Council of 27 January 1997 concerning novel foods and novel food ingredients.
7. Commission recommendation of 29 July 1997 concerning scientific aspects and the presentation of information necessary to support applications for the placing on the market of novel foods and novel food ingredients and the preparation of initial assessment reports under Regulation No 258/97 of the European Parliament and Council.
8. Commission Regulation (EC) No 50/2000 of 10 January 2000 on the labelling of foodstuffs and food ingredients containing additives and flavourings that have been genetically modified or have been produced from genetically modified organisms.
9. Council Regulation (EC) No 1139/98 of 26 May 1998 concerning the compulsory indication of the labelling of certain foodstuffs produced from genetically modified organisms of particulars other than those provided for in Directive 79/112/EEC.
10. Commission Regulation (EC) No 49/2000 of 10 January 2000 amending Council Regulation (EC) No 1139/98 concerning the compulsory indication on the labelling of certain foodstuffs produced from genetically modified organisms of particulars other than those provided for in Directive 79/112/EEC.
11. Council Directive 70/457/EEC of 29 September 1970 on the common catalogue of varieties of agricultural plant species.
13. Council Directive 90/220/EEC of 23 April 1990 on the deliberate release into the environment of genetically modified organisms.
14. 96/281/EC: Commission Decision of 3 April 1996 concerning the placing on the market of genetically modified soya beans (Glycine max L.) with increased tolerance to the herbicide glyphosate, pursuant to Council Directive 90/220/EEC.
15. 97/98/EC: Commission Decision of 23 January 1997 concerning the placing on the market of genetically modified maize (Zea mays L.) with the combined modification for insecticidal properties conferred by the Bt-endotoxin gene and increased tolerance to the herbicide glufosinate ammonium pursuant to Council Directive 90/ 220/EEC.