LIETUVOS RESPUBLIKOS ŽEMĖS ŪKIO MINISTRO
Į S A K Y M A S
DĖL ŽALIO IR TERMIŠKAI APDOROTO PIENO ANALIZĖS METODŲ TAIKYMO TECHNINIO REGLAMENTO PATVIRTINIMO
2001 m. kovo 23 d. Nr. 72
Vilnius
Įgyvendindamas Lietuvos Respublikos Vyriausybės Lietuvos pasirengimo narystei ES programos (Nacionalinė Acquis priėmimo programa) priemonių planą ir siekdamas tobulinti žalio pieno kokybės vertinimo sistemą ir adaptuoti ES reglamentuojamus žalio ir termiškai apdoroto pieno analizės metodus,
PATVIRTINTA
žemės ūkio ministro
2001 03 23 įsakymu Nr. 72
ŽALIO IR TERMIŠKAI APDOROTO PIENO ANALIZĖS METODŲ TAIKYMO TECHNINIS REGLAMENTAS
Parengtas pagal 1991 m. vasario 14 d. Europos Tarybos sprendimą 91/180/EEB, nustatantį tam tikrus žalio ir termiškai apdoroto pieno analizės ir kontrolės metodus.
BENDROSIOS NUOSTATOS
1. Šis techninis reglamentas nustato:
1.1. Žalio pieno analizės ir kontrolės pamatinius metodus:
1.1.2. bendro bakterijų skaičiaus nustatymo pagal skaičiuojamas kolonijas 30oC temperatūroje (6 priedas);
1.2. Pasterizuoto pieno analizės ir kontrolės pamatinius metodus:
1.2.4. bendro bakterijų skaičiaus nustatymo pagal skaičiuojamas kolonijas 30oC temperatūroje (6 priedas);
1.3. Ultraaukštoje temperatūroje apdoroto ir sterilizuoto pieno analizės ir kontrolės pamatinius metodus:
1.3.1. bendro bakterijų skaičiaus nustatymo pagal skaičiuojamas kolonijas 30oC temperatūroje (6 priedas);
2. Šių pamatinių analizės ir bandymų metodų tikslumo kriterijai, jų atlikimo, bandymų protokolo bendrieji reikalavimai apibūdinti 1 priede.
3. Reikalavimai žalio ir termiškai apdoroto pieno bandinių paėmimui, jų identifikavimui, gabenimui ir saugojimui, taikant šiuos pamatinius metodus, pateikti 2 priede.
4. Šie pamatiniai analizės ir kontrolės metodai taikomi:
4.1. patikrinti, ar žalio ir termiškai apdoroto pieno analizei naudojami tinkami įprastiniai (rutininiai) analizės metodai;
1 priedas
I. BENDRIEJI REIKALAVIMAI
1. Šiame priede apibūdinti naudojamų reagentų, įrangos, analizės rezultatų išreiškimo, tikslumo ir bandymo protokolų bendrieji reikalavimai.
2. Reagentai:
2.1. Vanduo:
2.1.1. Jeigu nenurodyta kitaip, tirpinimui, skiedimui ar plovimui naudojamas distiliuotas vanduo, dejonizuotas vanduo arba ekvivalentiško grynumo demineralizuotas vanduo. Nustatant mikrobiologinius rodiklius, jame neturi būti medžiagų, kurios gali paveikti ar turėti įtakos mikroorganizmų augimui analizės sąlygomis.
3. Įranga:
3.1. Įrangos sąrašai:
Skirtinguose pamatiniuose metoduose pateiktuose įrangos sąrašuose yra tik specialios paskirties ir konkretiems techniniams reikalavimams skirta įranga.
4. Rezultatų išraiška:
4.1. Rezultatai:
Bandymo protokole nurodyti rezultatai turi būti dviejų bandymų, tenkinančių tam metodui nurodytą pakartojamumo kriterijų (5.1.1 p.), rezultatų aritmetinis vidurkis, jeigu nenurodyta kitaip. Jeigu pakartojamumo kriterijus nepatenkinamas, bandymą reikia pakartoti arba rezultatas paskelbiamas negaliojančiu.
5. Tikslumo kriterijai yra pakartojamumas ir atitikimas:
5.1. Kiekvieno metodo tikslumo kriterijai apibūdinami taip:
5.1.1. Pakartojamumas (r) – tai reikšmė, žemiau kurios yra dviejų atskirų analizių, atliktų su tuo pačiu bandiniu, tuo pačiu metodu, tomis pačiomis sąlygomis (tas pats analitikas, ta pati įranga, laboratorija, per trumpą laiko tarpą), absoliutus rezultatų skirtumas.
5.1.2. Atitikimas (R) – tai reikšmė, žemiau kurios yra dviejų atskirų analizių, atliktų su tuo pačiu bandiniu, tuo pačiu metodu, skirtingomis sąlygomis (skirtingas analitikas, skirtinga įranga, laboratorija, ir/arba skirtingu laiku), absoliutus rezultatų skirtumas.
5.1.3. Jeigu nenurodyta kitaip, pakartojamumo ir atitikimo kriterijų reikšmės kiekvienam metodui nurodytos su 95 % tikimybe pagal ISO 5725:2-1986. Jos apskaičiuotos pagal pripažintų tarplaboratorinių bandymų, skirtų metodo įvertinimui, rezultatus. Tačiau kai kuriems metodams tarplaboratoriniai bandymai nebuvo atlikti. Tokiu atveju pakartojamumo ir atitikimo vertės buvo apskaičiuotos.
6. Bandymo protokolas:
Bandymo protokole nurodomas taikytas analizės metodas ir gauti rezultatai. Be to, jame turi būti paminėtos visos metodikos detalės, nenurodytos analizės metode, arba kurios yra neprivalomos, taip pat visos aplinkybės, kurios galėjo daryti poveikį gautam rezultatui. Bandymo protokolas turi suteikti visą informaciją, reikalingą bandiniui identifikuoti.
______________
2 priedas
ŽALIO IR TERMIŠKAI APDOROTO PIENO BANDINIŲ PAĖMIMAS
1. Šis pamatinis metodas apibūdina žalio ir termiškai apdoroto pieno bandinių paėmimą, saugojimą ir gabenimą imant bandinius iš gamintojo pristatyto žalio pieno, taip pat iš saugojimo ir gabenimo cisternose esančio žalio ir termiškai apdoroto pieno.
2, 4.4, 5 ir 6 punktuose pateikti reikalavimai taikomi imant termiškai apdoroto pieno, skirto tiesioginiam vartojimui, bandinius.
2. Termiškai apdoroto pieno bandinius iš bidonų, talpyklų ir kt. turi imti patyręs, prieš tai tinkamai apmokytas asmuo. Jeigu būtina, įgaliotos valstybės institucijos arba bandymų laboratorijos turi instruktuoti bandinius imantį personalą apie bandinių paėmimo techniką, siekiant, kad bandinys atitiktų visą siuntą, ir apie bandinių ženklinimą, užtikrinant bandinio identiškumą.
3. Bandinių ėmimo priemonės:
3.1. Bandinių ėmimo priemonės turi būti pagamintos iš nerūdijančio plieno arba kitos tinkamos tokio pat stiprumo medžiagos ir tokios konstrukcijos, kad tiktų numatomiems tikslams (maišymui, bandinio paėmimui, t. t.). Skysčiams maišyti induose skirtos nardinamosios maišyklės ir maišytuvai turi būti tokio dydžio, kad sukeltų pakankamą skysčio judėjimą, bet dėl maišymo neatsirastų gaižus kvapas. Samtis turi turėti nelanksčią, pakankamo ilgio rankeną, kad bandinį būtų galima paimti iš bet kokio gylio. Samčio talpa turi būti ne mažesnė kaip 50 ml.
3.2. Bandinių tara ir jos uždoris turi būti iš stiklo, tinkamo metalo arba plastmasės. Bandinių ėmimo priemonės (įskaitant bandinių tarą ir uždorius) turi būti iš tokių medžiagų, kad nesukeltų jokių pakitimų, galinčių turėti įtakos analizės rezultatams. Visi bandinių paėmimo priemonių ir taros paviršiai turi būti švarūs, sausi, lygūs ir be įtrūkimų, jų kampai turi būti suapvalinti.
3.3. Bandinių ėmimo priemonės mikrobiologiniams tyrimams:
Bandinių ėmimo priemonės, įskaitant ir tarą, be 3.1 p. pateiktų reikalavimų, turi būti dar ir sterilios. Jeigu ta pati bandinių ėmimo priemonė naudojama ir kitam bandiniui imti, po kiekvieno bandinio paėmimo ją reikia nuplauti ir apdoroti pagal bandymų laboratorijos ar įgaliotos valstybės institucijos nurodymus ar reikalavimus, kad neturėtų įtakos vienas po kito imamų bandinių tyrimo rezultatams.
4. Bandinių ėmimo technika:
4.1. Bendrosios nuostatos:
4.1.1. Nepaisant, kokiai pieno analizei imamas bandinys, pienas gerai išmaišomas rankiniu arba mechaniniu būdu. Bandinys imamas iš dar judančio pieno.
4.1.2. Kai iš talpyklos tuo pačiu metu imama keletas pieno bandinių skirtingiems bandymams, pirmiausia turi būti paimtas bandinys mikrobiologiniam tyrimui.
4.2. Bandinių ėmimas rankiniu būdu:
4.2.1. Bandinių paėmimas iš pieno kibirų ir bidonų:
Maišant pieną kibire ar bidone, nardinamoji maišyklė greitai judinama aukštyn ir žemyn, kad pienas gerai susimaišytų ir grietinėlė nepriliptų prie bidono kaklo. Visą siuntą reprezentuojantis bandinys turi būti paimtas, kaip nurodyta 4.2.4 p.
4.2.2. Bandinių paėmimas iš fermoje atšaldyto pieno cisternų ar statinių:
Pienas maišomas mechaniniu ar rankiniu būdu, kol pasiekiamas pakankamas homogeniškumas. Jeigu pieno tūris yra toks, kad mechaniškai sumaišyti pieno negalima, jis maišomas rankiniu būdu.
4.2.3. Bandinių ėmimas iš svėrimo vonios:
Labai svarbu, kad supiltas į svėrimo vonią pienas būtų reikiamai sumaišytas. Kad riebalai pasiskirstytų tolygiai, gali prireikti papildomai pamaišyti pieną rankiniu ar mechaniniu būdu. Kai pieno siuntos, iš kurios reikia paimti bandinį, tūris didesnis kaip svėrimo indo tūris, visą siuntą reprezentuojantis bandinys turi būti paimtas, kaip nurodyta 4.2.4 p.
4.2.4. Bandinių ėmimas iš atidalytų kiekių:
Kai pieno kiekis, iš kurio reikia paimti bandinius, yra ne vienoje talpykloje, imamas jo reprezentatyvus kiekis iš kiekvienos talpyklos atskirai, pažymint pieno kiekį, kuriam priklauso kiekvienas bandinys. Jeigu iš kiekvienos talpyklos paimtų bandinių nereikia bandyti atskirai, paimti reprezentatyvūs pieno kiekiai sumaišomi tokiu santykiu, kuris atitiktų esančius pieno kiekius talpyklose, iš kurių jie buvo paimti. Bandiniai analizėms imami iš šio surinkto kiekio, prieš tai jį išmaišius.
4.2.5. Bandinių ėmimas iš didelių talpyklų – laikymo rezervuarų, geležinkelio ir autocisternų:
4.2.5.1. prieš imant bandinius, pienas išmaišomas tinkamu būdu. Didelių talpyklų arba laikymo rezervuarų, geležinkelio ir autocisternų turiniui išmaišyti rekomenduojamas mechaninis būdas (4.2.5.2 p.).
Maišymo intensyvumas priklauso nuo laiko, kurį pienas buvo ramybės būklėje. Konkrečiu atveju taikomų maišymo metodų efektyvumas turi atitikti numatomas atlikti analizes. Maišymo efektyvumas turi didelės įtakos bandinių, paimtų iš skirtingų siuntos vietų arba tam tikrais laiko tarpais iš rezervuaro išleidimo angos, analizės rezultatų pakartojamumui. Pieno maišymo procedūra yra efektyvi, jeigu dviejų skirtingomis sąlygomis paimtų bandinių riebalų kiekio analizės rezultatų skirtumas yra ne didesnis kaip 0,1%.
Prie didelių indų dugne esančios išleidimo angos gali būti nedidelis kiekis pieno, kuris, net ir jį sumaišius, nereprezentuoja viso jo kiekio, todėl bandinius geriau imti per liuką. Jeigu bandiniai imami per išleidimo angą, išleidžiamas pakankamas pieno kiekis, užtikrinant, kad bandiniai atitiktų visą pieną;
4.2.5.2. pieną didelėse talpyklose, laikymo rezervuaruose, geležinkelio ir autocisternose galima maišyti tokiais būdais:
- mechaninėmis maišyklėmis, įtaisytomis rezervuaruose ir varomomis elektriniu motoru;
- maišyklėmis su propeleriu, varomomis elektriniu motoru ir uždėtomis ant liuko taip, kad maišyklė būtų panardinta piene;
- recirkuliuojant pieną per perpylimo žarną, prijungtą prie geležinkelių ir autocisternų išleidimo siurblių ir įleistą per liuką;
- švariu, išvalytu, suspaustu oru. Šiuo atveju reikėtų naudoti minimalų oro slėgį ir tūrį, kad neatsirastų gaižus kvapas.
4.3. Automatinis arba pusiau automatinis bandinių ėmimas:
4.3.1. Bandiniui paimti iš gamintojo pristatyto pieno galima naudoti automatines ar pusiau automatines priemonės pagal bandymų laboratorijos ar kitos įgaliotos valstybės institucijos pateiktus nurodymus. Prieš pradedant naudoti šią įrangą ji turi būti išbandoma, taip pat reguliariai bandoma naudojimo metu pagal įgaliotos valstybės institucijos nurodymus. Tikrinant bandinių ėmimo metodo (įrangos) tinkamumą reikia nustatyti:
4.3.2. Kai naudojama automatinė ar pusiau automatinė bandinių ėmimo įranga, įgaliota valstybės institucija gali nurodyti:
4.4. Termiškai apdoroto pieno bandinių ėmimas iš prekinės taros:
Tiesioginiam vartojimui skirto termiškai apdoroto pieno prekinėje taroje bandinį sudaro visa nepažeista pakuotė. Jeigu galima, bandinys imamas iš pakavimo mašinos arba šaldymo patalpos kaip galima greičiau po perdirbimo. Rekomenduojama pasterizuoto pieno bandinį imti pagaminimo dieną. Termiškai apdoroto pieno (pasterizuoto, ultraaukšta temperatūra apdoroto ir sterilizuoto) bandiniai imami pagal bandymų laboratorijos arba įgaliotos valstybės institucijos nurodymus ir jų kiekis priklauso nuo numatomų atlikti analizių kiekio.
5. Bandinio identifikavimas:
Bandiniai ženklinami kodu tokiu būdu, kad naudojantis bandymo laboratorijos ar įgaliotos valstybės institucijos nurodymais jį būtų galima lengvai atpažinti.
6. Bandinių gabenimas ir laikymas:
6.1. Tyrimų laboratorija turi parengti instrukcijas dėl bandinių gabenimo ir laikymo sąlygų ir laikotarpio tarp bandinio paėmimo ir jo analizės, atsižvelgiant į pieno rūšį ir būsimą analizę. Instrukcija turi būti išdėstyta pagal įgaliotos valstybės institucijos reikalavimus.
6.2. Instrukcijoje turi būti išdėstyti tokie reikalavimai:
6.2.1. Bandinio gabenimo ir laikymo metu reikia imtis atsargumo priemonių, siekiant jį apsaugoti nuo užteršimo pašaliniais kvapais ir tiesioginių saulės spindulių. Jeigu bandinio tara peršviečiama, ją reikia laikyti tamsioje vietoje.
6.2.2. Žalio pieno bandiniai, skirti mikrobiologinei analizei, turi būti gabenami ir laikomi (0–4)°C temperatūroje. Laiko tarpas tarp bandinių ėmimo ir analizės turi būti kiek galint trumpesnis ir jokiu būdu neviršyti 36 valandų. Jeigu laiko tarpas tarp bandinio ėmimo ir analizės neviršija 24 valandų, įgaliota valstybės institucija gali leisti laikyti žalio pieno bandinius (0–6)°C temperatūroje.
6.2.3. Mikrobiologinei analizei skirti pasterizuoto pieno bandiniai turi būti gabenami ir laikomi (0–4)°C temperatūroje. Laiko tarpas tarp bandinių ėmimo ir analizės turi būti kiek galint trumpesnis ir jokiu būdu ne ilgesnis kaip 24 valandų.
3 priedas
UŽŠALIMO TEMPERATŪROS NUSTATYMAS
1. Taikymo sritis:
1.1. Šis pamatinis metodas apibūdina žalio, pasterizuoto, ultraaukštoje temperatūroje apdoroto ir sterilizuoto nenugriebto, pusriebio ir nugriebto pieno užšalimo temperatūros nustatymą, naudojant prietaisą (termistorinį krioskopą), kuriame termostatinė vonia šaldoma elektra, o stiklinis gyvsidabrio termometras pakeistas termistoriniu zondu.
1.2. Naudojami dviejų tipų prietaisai. Pirmojo tipo prietaisai nustato aukščiausią užšalimo tašką (temperatūrą) užšalimo kreivės plokščiojoje dalyje, antrojo tipo prietaisai – temperatūrą tam tikru laiku kristalizacijai prasidėjus. Kadangi vieno pieno užšalimo temperatūros kreivės gali skirtis ir nuo kito pieno, ir nuo kalibravimui naudojamo etaloninio tirpalo kreivių, šiame pamatiniame metode reikalaujama naudoti pirmojo tipo kreives rodančius prietaisus. Antrojo tipo prietaisus, matuojančius temperatūrą nustatytu laiku, galima naudoti rutininiams matavimams.
2. Apibrėžimas:
Pieno užšalimo temperatūra – dydis, nustatytas apibūdintu metodu ir išreikštas Celsijaus laipsniais (°C).
3. Metodo esmė:
3.1. Pieno mėginys peršaldomas iki nustatytos temperatūros (pagal tai, koks prietaisas naudojamas) ir mechanine vibracija sukeliamas kristalizavimasis, dėl ko temperatūra sparčiai kyla iki kreivės plokščiosios srities temperatūros reikšmės, kuri atitinka bandinio užšalimo temperatūrą.
4. Prietaisai ir stikliniai indai:
Paprastai naudojama ši laboratorinė įranga:
4.1. Krioskopas:
Krioskopas susideda iš termostatinės šaldymo vonios, termistorinio zondo (puslaidininkinio varžinio termometro) su jo grandine ir galvanometro arba automatinio atskaitos įtaiso, mėginio maišytuvo bei įtaiso kristalizavimuisi sukelti kartu su mėginio mėgintuvėliais:
4.1.1. Šaldymo vonios gali būti dviejų rūšių:
4.1.1.1. panardinamoji vonia – tai gerai izoliuota vonia su tinkamu šaldymo skysčiu, kuris maišomas taip, kad temperatūrų skirtumas tarp bet kurių dviejų skysčio taškų nebūtų didesnis kaip 0,2°C. Skysčio temperatūra neturi svyruoti daugiau nei ± 0,5°C nuo gamintojo instrukcijoje įvardytos temperatūros. Svarbu palaikyti pastovų skysčio lygį vonioje. Mėgintuvėlis panardinamas taip, kad jo talpos žymė būtų sulig šaldymo skysčio lygiu;
4.1.1.2. cirkuliacinė vonia – tai vonia, kurioje šaldymo skysčio srovė nuolat cirkuliuoja aplink mėgintuvėlį su mėginiu. Šaldymo skysčio temperatūra neturi svyruoti daugiau kaip ± 0,5° C nuo gamintojo instrukcijoje įvardytos temperatūros. Tinkamas šaldymo skystis yra 3,3 % (pagal tūrį) etano 1,2 diolio (etileno glikolio) vandeninis tirpalas.
4.1.2. Termistorius ir su juo susijusi grandinė:
4.1.2.1. termistorius turi būti stiklinio zondo tipo, jo skersmuo neturi būti didesnis kaip (1,80 ± 0,2) mm ir išvadų skersmuo ne didesnis kaip 0,31 mm. Termistoriaus laiko konstanta negali būti didesnė kaip 2 s ir dydis (žr. 4.1.2.2 p.) turi būti didesnis kaip 3000. Darbinė įtampa, srovė ir sklaidos konstanta turi būti tokie, kad termistoriaus temperatūra nepakiltų daugiau nei 0,0005°C virš jį supančios aplinkos, esant minus 0,512°C temperatūrai. Maksimali leistinos varžos paklaida turi būti ± 5 %. Kai krioskope zondas yra darbo padėtyje, jo stiklinio korpuso galas turi būti mėgintuvėlio ašyje ir (44,6 ± 0,1) mm žemiau mėgintuvėlio viršaus (žr. pav.). Reikalingas šablonas, padedantis vartotojui įstatyti zondą į šią padėtį;
4.1.2.2. β apibūdina termistoriaus varžos temperatūrinę priklausomybę pagal formulę:
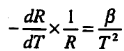
čia: T – temperatūra Kelvinais;
R – varža omais, kai temperatūra yra T;
![]() - temperatūrinis varžos koeficientas;
- temperatūrinis varžos koeficientas;
β – konstanta, priklausanti nuo termistoriaus medžiagos. Šiuolaikinėje praktikoje rekomenduojama, kad dydis β būtų didesnis kaip 3000.
4.1.3. Matavimo įtaisas ir automatinis atskaitos įtaisas:
4.1.3.1. matavimo principas:
Naudojamas prietaisas turi užregistruoti pirmąją plokščiąją sritį užšalimo temperatūros kreivėje. Plokščioji sritis – tai kreivės dalis, kurioje temperatūra išlieka pastovi ± 0,002°C tikslumu ne mažiau kaip 20 s;
4.1.3.2. rankinis atskaitos įtaisas:
Termistoriaus varža turi būti balansuojama Wheatstone tiltu ar panašiu įtaisu, naudojant aukščiausios kokybės stabilius rezistorius, kurių varžų leistinas nuokrypis ne didesnis kaip ± 10 % ir temperatūrinis varžos koeficientas neviršija 2 x 10-5°C-1. Derinamojo rezistoriaus reguliavimo netiesiškumas visame reguliavimo ruože neturi viršyti 0,3 % maksimalios varžos. Turi būti rezistorių suderinimo priemonės, skirtos kalibravimo tikslams. Matavimo skalės padalos vertė neturi būti didesnė kaip 0,001°C;
4.1.3.3. automatinis atskaitos įtaisas:
Automatinio atskaitos įtaiso skiriamoji galia temperatūros diapazone nuo 0 iki minus 1°C turi būti ne mažesnė kaip 0,001°C. Automatinio atskaitos įtaiso ir su juo susijusių grandinių stabilumas turi būti toks, kad tos pačios temperatūros vienas po kito einantys rodmenys nesiskirtų daugiau kaip 0,001°C. Grandinės tiesiškumas turi būti toks, kad, prietaisui teisingai dirbant, bet kuriame diapazono nuo minus 0,400°C iki minus 0,600°C taške paklaida nebūtų didesnė kaip ± 0,001°C.
4.1.4. Vielinė maišyklė:
Mėginiui maišyti naudojama pienui inertiška (1–1,5) mm skersmens metalinė viela. Vielinės maišyklės ilgis turi būti tinkamai parinktas; vielinė maišyklė turi būti įtaisoma vertikaliai, o jos apatinis galas turi būti vieno lygio su termistorinio zondo galvute. Leidžiamas 1,5 mm nuokrypis į viršų arba į apačią nuo šios padėties. Vielinė maišyklė turi vibruoti į šonus su pakankama gamintojo nustatyta amplitude (bet ne mažesne kaip ± 1,5 mm), siekiant užtikrinti viso mėginio temperatūros vienodumą rezultato nustatymo metu. Maišant vielinė maišyklė niekada neturi liesti termistorinio zondo arba mėgintuvėlio sienelių.
4.1.5. Kristalizacijos sukėlimo įtaisas:
Tai gali būti bet koks įtaisas, sukeliantis mėginio kristalizaciją, dėl ko temperatūra kyla iki užšalimo temperatūros. Šiam tikslui gali būti panaudota vielinė maišyklė; vienas būdas yra (1–2) s padidinti vibravimo amplitudę tiek, kad viela atsitrenkinėtų į mėgintuvėlio sieneles.
4.1.6. Mėgintuvėliai:
Mėgintuvėliai (žr. pav.) turi būti stikliniai, jų ilgis – (50,8 ± 0,1) mm; išorinis skersmuo – (16,0 ± 0,1) mm, vidinis skersmuo – (13,5 ± 0,1) mm. Sienelės storis visame vamzdelyje neturi skirtis daugiau kaip 0,1 mm. 29,8 mm nuo mėgintuvėlio viršaus (21 mm virš mėgintuvėlio dugno) turi būti talpos žymė, rodanti mėginio (2,5 ± 0,1) ml tūrį.
4.4. Džiovinimo krosnelė, gerai ventiliuojama, galinti palaikyti (130 ± 1)°C temperatūrą, arba elektrinė krosnis, ventiliuojama ir galinti palaikyti (300 ± 25)°C temperatūrą.
5. Reagentai:
5.1. Vanduo, distiliuotas borosilikatinio stiklo įrenginiu, užvirintas ir atšaldytas iki (20±2) °C kolbutėje, kurioje yra anglies dvideginį absorbuojantis vamzdelis.
5.2. Natrio chloridas, analiziškai grynas, smulkiai sumaltas, džiovintas 5 h džiovinimo krosnelėje (300 ± 2)°C temperatūroje arba 24 h – džiovinimo krosnelėje (130 ± 1) oC temperatūroje ir atšaldytas iki kambario temperatūros paruoštame eksikatoriuje.
5.3. Etaloninių tirpalų paruošimas:
5.3.1. Svėrimo indelyje atsveriamas reikiamas kiekis (žr. 1 lentelę) sauso natrio chlorido (5.2 p.). Ištirpinama distiliuotame vandenyje (5.1 p.), visiškai perpilama į 1000 ml talpos vienažymę matavimo kolbą ir atskiedžiama iki žymės (20 ± 2)°C temperatūros vandeniu. Laikoma ne ilgiau kaip 2 mėnesius 5°C temperatūroje sandariai uždarytuose polietileno buteliuose, kurių talpa ne didesnė kaip 250 ml.
5.3.2. Prieš naudojant etaloninį tirpalą, butelis iš lėto apverčiamas ir sukamuoju judesiu keletą kartų gerai išmaišomas. Etaloninio tirpalo negalima smarkiai maišyti, kad į jį nepatektų oro.
5.3.3. Etaloninio tirpalo bandinį būtina išpilti iš butelio, supilant jį į švarią sausą stiklinę, jokiu būdu tam tikslui negalima naudoti pipečių.
5.3.4. Negalima naudoti tirpalų, jei butelyje jų yra likę mažiau nei ketvirtadalis butelio talpos ir jeigu jie nėra konservuoti fungicidu (pvz., tiomersalo tirpalu, 10 g/l) ir laikyti ilgiau kaip du mėnesius.
1 lentelė. Natrio chlorido tirpalų užšalimo temperatūra 20° C temperatūroje.
| NaCl, g/l |
oC |
| 6,859 |
- 0,408 |
| 7,818 |
- 0,464 |
| 8,149 |
- 0,483 |
| 8,314 |
- 0,492 |
| 8,480 |
- 0,502 |
| 8,646 |
- 0,512 |
| 8,811 |
- 0,521 |
| 8,977 |
- 0,531 |
| 9,143 |
- 0,541 |
| 10,155 |
- 0,600 |
6. Termistorinio krioskopo kalibravimas:
6.1. Krioskopas turi būti įrengtas taip, kad aplinkos oro temperatūra nesiskirtų daugiau nei 1 °C nuo tos temperatūros, kurioje atliekamas kalibravimas. Prietaisas turi būti apsaugotas nuo saulės spindulių arba skersvėjų, o jo darbo patalpos temperatūra turi būti ne aukštesnė kaip (26-27)°C.
6.2. Pagal gamintojo instrukcijas patikrinama, ar krioskopas yra geros būklės ir prietaisas įjungiamas ne mažiau kaip 12 h iki kalibravimo. Patikrinama zondo padėtis, vielinės maišyklės vibravimo amplitudė ir šaldymo skysčio temperatūra.
6.3. Parenkami du etaloniniai tirpalai (žr. 1 lentelę), kurių užšalimo temperatūros būtų artimos numatomai pieno mėginio užšalimo temperatūrai. Pageidautina, kad skirtumas tarp šių dviejų tirpalų užšalimo temperatūrų būtų ne mažesnis kaip minus 0,100°C. (Kai kurių šiuo metu naudojamų krioskopų konstrukcijoje su termistoriumi susijusi grandinė yra sukonstruota tokiu būdu, kad ji balansuoja, esant tam tikrai užšalimo temperatūros reikšmei prietaiso matavimo diapazone. Šiais atvejais etaloninio tirpalo su tokia užšalimo temperatūra panaudojimas palengvina kalibravimo procedūrą. Tą reikšmę turi nurodyti gamintojas.)
6.4. Į švarų sausą mėgintuvėlį pipete įpilama (2,5 ± 0,1) ml vieno iš etaloninių tirpalų ir matuojama krioskopu.
6.5. Kalibravimui naudojami mėgintuvėliai turi būti pagaminti iš to paties tipo stiklo kaip ir mėgintuvėliai, naudojami pieno mėginių tyrimui. Visi mėgintuvėliai turi būti išplauti ir praskalauti demineralizuotu vandeniu tuo pačiu metu. Etaloninių tirpalų temperatūra turi būti panaši į pieno mėginio temperatūrą.
6.6. Kalibravimo rankenėlės reguliuojamos pagal gamintojo instrukciją taip, kad krioskopo rodmenys atitiktų etaloninio tirpalo užšalimo temperatūrą. Ši procedūra pakartojama su kitu etaloniniu tirpalu, po to vėl su pirmuoju etaloniniu tirpalu iki tol, kol kiekvieno tirpalo vienas po kito einantys rodmenys, nereguliuojant kalibravimo rankenėlių, atitiks tų etaloninių tirpalų užšalimo temperatūras. Tada krioskopas parengtas naudoti ir tiesiogiai be jokių koregavimų parodo pieno mėginio užšalimo temperatūrą.
7. Bandinio paruošimas:
7.2. Iš bandinio išimamos visos matomos priemaišos arba kieti sviesto riebalų grūdeliai, jei reikia, bandinys filtruojamas į švarų sausą indą ir atsargiai išmaišomas. Jeigu naudojamas filtras, jis turi būti inertiškas pieno atžvilgiu ir veiksmingas laboratorijos temperatūroje.
7.3. Pieno bandiniai gali būti tiriami laikymo temperatūros (0–5)°C arba jiems galima leisti pasiekti laboratorijos temperatūrą. Tačiau būtina, kad tiriant pieno bandinių ir etaloninių tirpalų temperatūra būtų vienoda.
7.4. Pieno titruojamasis rūgštingumas nustatomas, jei įmanoma, tuo pačiu laiku, kai atliekamas užšalimo temperatūros tyrimas. Bandiniai, kurių pieno rūgštingumas didesnis kaip 0,18 g pieno rūgšties 100 ml pieno, negali būti tiriami.
8. Metodika:
8.1. Parengiamasis patikrinimas:
Patikrinama, ar šaldymo skysčio temperatūra ir lygis atitinka gamintojo instrukciją ir, jeigu naudojamas termistorinis zondas, patikrinama jo padėtis tuščiame mėginio mėgintuvėlyje. Įjungiamas krioskopas ir įsitikinama, kad šaldymo skystis būtų tinkamai maišomas arba cirkuliuojamas. Po 12 h nuo įjungimo patikrinama šaldymo skysčio temperatūra, taip pat vielinės maišyklės padėtis ir vibravimo amplitudė.
8.2. Privalomasis kalibravimo patikrinimas:
Prieš kiekvieną tyrimų seriją matuojama natrio chlorido tirpalo užšalimo temperatūra (pvz., tirpalo, kurio užšalimo temperatūra minus 0,512° C) iki dviejų vienas po kito einančių rodmenų skirtumas bus ne didesnis kaip 0,001°C. Jeigu šių reikšmių vidurkis skiriasi nuo etaloninio tirpalo užšalimo temperatūros daugiau kaip 0,002°C, krioskopas kalibruojamas pakartotinai, kaip aprašyta 6 p. Jeigu krioskopas naudojamas nepertraukiamai, tai privalomasis kalibravimo patikrinimas atliekamas ne rečiau kaip kas valandą. Būtina atsižvelgti į gamintojo instrukciją.
8.3. Pieno užšalimo temperatūros nustatymas:
8.3.1. Pieno bandinio indelis atsargiai apverčiamas ir keletą kartų apsukamas, kad susimaišytų jo turinys. Bandinio negalima maišyti labai stipriai, kad į jį neprisiplaktų oro.
8.3.2. Į švarų sausą mėgintuvėlį pipete įpilama (2,5 ± 0,1) ml pieno, jo perteklius pašalinamas pipete. Patikrinama, ar termistorinis zondas ir vielinė maišyklė yra sausi ir švarūs, jei reikia, jie atsargiai nuvalomi minkšta, švaria, nepaliekančia plaušelių servetėle, traukiant iš apačios į viršų.
8.3.3. Mėgintuvėlis įstatomas pagal gamintojo nurodymus į kalibruotą krioskopą. Pienas bus šaldomas ir sukeliamas jo kristalizavimasis, kai bus pasiekta krioskopo gamintojo nurodyta temperatūra 0,1°C tikslumu. (Kai kuriuose automatiniuose prietaisuose šią temperatūrą galima stebėti automatiniame skaitmeniniame atskaitos įtaise; rankinio valdymo prietaisų reikiamas tikslumas gaunamas pasiekus, kad kristalizavimasis prasidėtų, kai galvanometro rodyklė sutampa su atitinkama žyme.)
8.3.4. Jeigu dėl kokios nors priežasties kristalizavimasis prasideda prieš arba po nurodytos temperatūros, tyrimas nutraukiamas ir pakartojamas su kita mėginio porcija. Jeigu pakartotinio mėginio kristalizavimasis vėl prasideda anksčiau už nurodytą temperatūrą, kita mėginio dalis pašildoma iki 45°C temperatūros, išlaikoma joje 5 minutes, kol ištirpsta riebalų kristalai.
8.3.5. Po to mėginys vėl atšaldomas iki tyrimo temperatūros ir iš karto tiriamas. Prasidėjus kristalizavimuisi, pieno temperatūra gretai kyla iki reikšmės, kuri išlieka tam tikrą laiką iš esmės pastovi ir vėl pradeda kristi. Užšalimo temperatūra atitinka aukščiausią pasiektą šiuo laiku reikšmę, ir ši reikšmė turi būti užrašyta.
8.3.6. Laiko tarpas, kai aukščiausioji temperatūra išlieka pastovi, taip pat laiko tarpas nuo kristalizavimosi pradžios iki aukščiausios temperatūros pasiekimo momento gali būti skirtingas, kai tiriami įvairūs mėginiai, o etaloninių natrio chorido tirpalų ir vandens mėginių yra trumpesni negu pieno.
8.3.7. Tyrimą tinkamai užbaigus, mėgintuvėlis išimamas, termistorinis zondas ir vielinė maišyklė nuplaunami vandeniu, nusausinami minkšta, švaria ir plaušelių nepaliekančia servetėle, valant iš apačios į viršų, po to tiriama kita pieno mėginio dalis.
8.3.8. Jeigu skirtumas tarp gautų užšalimo temperatūrų yra didesnis negu pakartojamumo reikšmė (0,004°C), dar kartą atliekami du vienas po kito tyrimai su naujomis mėginio porcijomis. Jeigu dvi nustatytos reikšmės sutampa 0,004°C ribose, jos užrašomos ir panaudojamos galutiniam rezultatui apskaičiuoti.
8.4. Zondo aušinimas:
Baigus dirbti su prietaisu, į mėginio vietą įdedamas tuščias mėgintuvėlis ir nuleidžiama darbinė galvutė, kad atauštų zondas. (Kai kurių konstrukcijų krioskopuose šito padaryti negalima; tais atvejais būtina užtikrinti, kad prieš tyrimus zondas būtų reikiamai atšaldomas, pavyzdžiui, atliekant keletą tuščiųjų tyrimų, kol gaunami patikimi rezultatai.)
9. Rezultatų išreiškimas:
9.1. Apskaičiavimas:
9.1.1. Jeigu įprastinis kalibravimas atliktas teisingai, apskaičiuojamas dviejų gautų užšalimo temperatūrų reikšmių vidurkis, suapvalinant iki trijų ženklų po kablelio.
9.1.2. Jeigu priimtinų dviejų tyrimo rezultatų aritmetinė suma yra nelyginis skaičius, aritmetinis vidurkis turi būti suapvalinamas iki artimiausio lyginio taip, kaip parodyta 2 lentelėje.
2 lentelė. Rezultatų suapvalinimo pavyzdys.
| Užšalimo temperatūra,°C |
||
| Tyrimų dvejeto rezultatai |
Aritmetinis vidurkis |
|
| - 0,544 |
- 0,545 |
- 0,544 |
| - 0,545 |
- 0,546 |
- 0,546 |
4 priedas
FOSFATAZĖS AKTYVUMO NUSTATYMAS
2. Apibrėžimas:
2.1. Fosfatazės aktyvumas yra produkte esantis aktyvios šarminės fosfatazės kiekis, išreikštas fenolio kiekiu mikrogramais, metodikoje aprašytomis sąlygomis išskiriamas iš 1 ml pasterizuoto pieno.
3. Metodo esmė:
Fosfatazės aktyvumas įvertinamas pagal fenolio kiekį, kuris išsiskiria į bandinį pridėjus dinatrio fenilfosfato. Išsiskyrusiam fenoliui reaguojant su dibromchinonchlorimidu, susidaro melsvos spalvos dibromindofenolis, kuris kolorimetriškai pamatuojamas, esant bangos ilgiui 610 nm. Palyginimas atliekamas su bandiniu, kuriame fermentas fosfatazė suardyta.
4. Reagentai:
4.1. Bario borato hidroksido tirpalas:
4.1.1. 50,0 g bario hidroksido (Ba(OH)2×8H2O) ištirpinama vandenyje ir praskiedžiama vandeniu iki 1000 ml.
4.1.3. 500 ml kiekvieno tirpalo pašildoma iki 50 oC, tirpalai sumaišomi, mišinys greitai atšaldomas iki 20 oC ir, jeigu reikia, jo pH sureguliuojamas iki 10,6±0,1, įpilant 4.1.1 p. arba 4.1.2 p. nurodytų tirpalų. Filtruojama. Tirpalas laikomas sandariai uždarytame inde.
4.2. Spalvos išryškinimo buferinis tirpalas:
6,0 g natrio metaborato (NaBO2) arba 12,6 g NaBO2×4H2O ir 20,0 g natrio chlorido (NaCl) ištirpinama vandenyje ir praskiedžiama iki 1000 ml.
4.3. Spalvos išryškinimo praskiestas buferinis tirpalas:
10 ml spalvos išryškinimo buferinio tirpalo (4.2 p.) praskiedžiama vandeniu iki 100 ml.
4.4. Buferinis substrato tirpalas:
4.4.1. 0,1 g dinatrio fenilfosfato dehidrato be fenolio ištirpinama 100 ml buferio (4.1.3 p.) arba 0,5 g dinatrio fenilfosfato ištirpinama 4,5 ml spalvos išryškinimo buferinio tirpalo (4.2 p.), įlašinami du lašai BQC tirpalo (4.6 p.) ir paliekama stovėti 30 min kambario temperatūroje. Spalvos ekstraktas atskiriamas 2,5 ml 1-butanolio ir paliekamas stovėti, kol atsiskiria 1-butanolis. 1-butanolis nupilamas. Jeigu reikia, ekstrakcija pakartojama.
4.5. Cinko-vario nusodiklis:
3,0 g cinko sulfato (ZnSO4×7H2O) ir 0,6 g vario (II) sulfato (CuSO4×5H2O) ištirpinama vandenyje ir vandeniu praskiedžiama iki 100 ml.
4.6. 2,6-dibromoksinonchlorimido tirpalas (BQC tirpalas):
(40 ± 1) mg 2,6-dibromoksinonchlorimido (BQC) (C6H2Br2CINO6) ištirpinama 10 ml 96% (pagal tūrį) etilo spirito. Tirpalas laikomas tamsaus stiklo butelyje šaldytuve. Praėjus vienam mėnesiui po tirpalo pagaminimo arba pranykus spalvai, jis išpilamas.
4.7. Vario (II) sulfato tirpalas:
0,05 g vario (II) sulfato (CuSO4×5H2O) ištirpinama vandenyje ir atskiedžiama iki 100 ml.
4.8. Etaloniniai fenolio tirpalai:
4.8.1. (200 ± 2) mg gryno bevandenio fenolio pasveriama į 100 ml matavimo kolbutę, pripilama vandens iki žymės ir sumaišoma. Laikomas šaldytuve šis pradinis tirpalas keletą mėnesių išlieka stabilus.
5. Įranga ir stikliniai indai:
Naudojama įprasta laboratorinė įranga:
5.9. Visi stikliniai indai, kamščiai ir bandinių ėmimo priemonės turi būti kruopščiai išplauti. Rekomenduojama juos išskalauti šviežiai virintu distiliuotu vandeniu arba išgarinti.
6. Metodika:
6.1. Bandinio paruošimas:
Analizę geriau atlikti tuoj pat paėmus bandinį. Kitu atveju bandinys laikomas šaldytuve ne ilgiau kaip dvi dienas.
6.2. Mėginys:
Į kiekvieną iš dviejų mėgintuvėlių (5.4 p.) pipete įpilama po 1 ml bandinio, vieną mėgintuvėlį naudojant tuščiajam bandiniui.
6.3. Nustatymas:
6.3.1. Tuščiojo bandymo mėgintuvėlis su turiniu dvi minutes kaitinamas verdančiame vandenyje; stiklinė su verdančiu vandeniu uždengiama aliuminine folija, kad kaistų visas mėgintuvėlis. Greitai atšaldoma iki kambario temperatūros.
6.3.2. Po to tuščiasis bandymas ir analizė su tiriamuoju mėginiu atliekami vienodai. Į mėgintuvėlius įpilama 10 ml buferio substrato (4.4 p.) ir sumaišoma.
6.3.3. Mėgintuvėliai tuoj pat įdedami 60 minučių į vandens vonią (5.2 p.), kartais pamaišant jų turinį (mažiausiai 4 kartus).
6.3.4. Mėgintuvėliai kaitinami verdančiame vandenyje 2 minutes, kaip nurodyta 6.3.1 p. Greitai atšaldomi iki kambario temperatūros.
6.3.5. Į kiekvieną mėgintuvėlį pridedama po 1 ml cinko-vario nusodiklio (4.5 p.) ir kruopščiai išmaišoma.
6.3.6. Mėgintuvėlių turinys nufiltruojamas naudojant sausą filtrinį popierių, pirmieji 2 ml išpilami, jeigu būtina, perfiltruojama, kol gaunamas skaidrus filtratas. Į mėgintuvėlį surenkama 5 ml filtrato.
6.3.8. Įpilama 0,1 ml BQC tirpalo (4.6 p.), sumaišoma ir 30 minučių laikoma kambario temperatūroje, kol išryškėja spalva.
6.3.9. Spektrofotometru (5.3 p.) pamatuojama absorbcija, lyginant su kontroliniu arba tuščiuoju bandiniu, esant 610 nm bangos ilgiui.
6.3.10. Jeigu pagal 6.3.9 p. pamatuota absorbcija viršija etaloninio tirpalo, kuriame yra 20 μg fenolio, absorbciją, pamatuotą pagal 6.4.4 p., analizė pakartojama atitinkamai atskiedus mėginį. Skiedžiama sumaišant vieną mėginio tūrio dalį su atitinkamu to paties mėginio tūriu, atsargiai pakaitintu iki virimo, kad būtų inaktyvuojama fosfatazė.
6.4. Kalibravimo kreivės paruošimas:
6.4.1. Pagaminami etaloniniai fenolio tirpalai (4.8.1 p.), kurių 1 ml būtų 0 (kontrolinis arba tuščiasis mėginys), 2, 5, 10 ir 20 μg fenolio ir į kiekvieną iš penkių mėgintuvėlių pipete atitinkamai įpilama po 1 ml vandens ir 1 ml vieno iš etaloninių fenolio tirpalų.
6.4.2. Į kiekvieną mėgintuvėlį įpilama po 1 ml vario (II) sulfato tirpalo (4.7 p.), 5 ml spalvos išryškinimo praskiesto buferinio tirpalo (4.3 p.), 3 ml vandens ir 0,1 ml BQC tirpalo (4.6 p.) ir sumaišoma.
6.4.4. Spektrofotometru pamatuojama absorbcija, lyginant su kontroliniu arba tuščiuoju bandiniu, esant 610 nm bangos ilgiui (5.3 p.).
7. Rezultatų apskaičiavimas:
7.1. Apskaičiavimas ir formulė:
7.1.1. Naudojant gautą regresijos tiesę (6.4.5 p.) pagal absorbcijos reikšmes (6.3.9 p.), apskaičiuojamas fenolio kiekis.
7.1.2. Fosfatazės aktyvumas, išreikštas fenolio mikrogramais 1 ml pasterizuoto pieno, apskaičiuojama pagal formulę:
Fosfatazės aktyvumas = 2,4 x A x D,
čia: A yra fenolio kiekis mikrogramais, gautas pagal 7.1.1 p.;
D yra praskiedimo koeficientas pagal 6.3.10 p. (jei nebuvo skiedžiama, D = 1);
2,4 yra praskiedimo koeficientas (5/12 viename ml mėginio). Žr. 6.2 p. kartu su 6.3.2, 6.3.5 ir 6.3.6 p.
5 priedas
PEROKSIDAZĖS AKTYVUMO NUSTATYMAS
1. Šis pamatinis metodas apibūdina fermento peroksidazės buvimo piene nustatymą ir naudojamas pieno pasterizavimo kontrolei.
2. Apibrėžimai:
2.1. Peroksidazės reakcija laikoma teigiama, jeigu per 30 sekundžių po pieno sumaišymo su reagentais mišinys nusidažo mėlyna spalva ir tai reiškia, kad pienas yra tinkamai pasterizuotas.
3. Metodo esmė:
Fermentas peroksidazė skaldo vandenilio peroksidą. Išsiskyręs atominis vandenilis oksiduoja bespalvį 1,4-fenilendiaminą į purpurinį indofenolį (Storch bandymas). Spalvos intensyvumas proporcingas fermento koncentracijai.
4. Reagentai:
4.1. 1,4 – fenilendiamino tirpalas:
2 g 1,4 fenilendiamino (C6H8N2) ištirpinama šiltame (50°C) vandenyje ir praskiedžiama vandeniu iki 100 ml. Tirpalas laikomas tamsiai rudo stiklo butelyje su stikliniu kamščiu vėsioje ir tamsioje vietoje. Praėjus 1-2 dienoms po paruošimo 1,4-fenilendiamino tirpale nusėda nuosėdos; tokiu atveju jį reikia išpilti.
4.2. Vandenilio peroksido tirpalas:
9 ml 30% vandenilio peroksido praskiedžiama vandeniu iki 100 ml. Tirpalo stabilumui padidinti į 1 l tirpalo pridedama 1 ml koncentruotos sieros rūgšties. Vandenilio peroksido tirpalas išlieka stabilus vieną mėnesį, jeigu jis yra laikomas vėsioje tamsioje vietoje, butelyje su stikliniu kamščiu, apsaugant jį nuo bet kokio sąlyčio su organiniais junginiais.
5. Metodika:
6 priedas
BENDRO BAKTERIJŲ SKAIČIAUS NUSTATYMAS PAGAL SKAIČIUOJAMAS KOLONIJAS 30°C TEMPERATŪROJE
1. Šis pamatinis metodas apibūdina bendro bakterijų skaičiaus nustatymą 30°C temperatūroje, skaičiuojant jų kolonijas. Metodas taikomas žaliam, pasterizuotam pienui, taip pat sterilizuotam ir ultraaukštoje temperatūroje apdorotam pienui, prieš tai 15 dienų išlaikytam 30°C temperatūroje.
2. Apibrėžimas:
Mikroorganizmai – tai organizmai, sugebantys suformuoti suskaičiuojamas kolonijas, laikant aerobinėmis nurodytomis sąlygomis.
3. Metodo esmė:
Tam tikras pieno bandinio tūris Petri lėkštelėse sumaišomas su mitybine terpe ir inkubuojamas 72 valandas 30°C temperatūroje. Suskaičiuojamos kolonijos ir apskaičiuojamas bendras bakterijų skaičius 1 ml žalio ar pasterizuoto pieno, arba 0,1 ml sterilizuoto ar ultaaukštoje temperatūroje apdoroto pieno su pradiniu išlaikymu.
4. Įranga ir stikliniai indai:
4.1. Naudojama įprastinė laboratorinė ir ši įranga:
4.2. Stikliniai indai:
4.2.1. Sandariai uždaromi, pakankamos talpos mėgintuvėliai, kuriuose galima sumaišyti 10 ml pirmojo skiedinio ar tolesnius dešimtkarčius skiedinius.
4.2.3. Pipetės (su vatos kamščiais), pagamintos iš stiklo ar sterilios sintetinės medžiagos, su nenudaužtu galu ir 1 ml talpos žyme, kurių ištekėjimo angos skersmuo (1,75–3) mm.
4.2.4. Petri lėkštelės, pagamintos iš skaidraus nespalvoto stiklo ar sterilios sintetinės medžiagos, kurių dugno vidinis skersmuo yra apie (90–100) mm. Jų gylis vidinėje dalyje turi būti mažiausiai 10 mm. Dugnas turi būti be nelygumų, trukdančių skaičiuoti kolonijas.
4.2.5. Stiklinių indų sterilizavimas:
4.2.5.1. Stikliniai indai turi būti sterilizuojami, taikant vieną iš šių metodų:
4.2.5.1.1. išlaikant juos sterilizavimo krosnyje ne trumpiau kaip vieną valandą (170–175) °C temperatūroje (4.1.1 p.);
4.2.5.2. Autoklave būtina užtikrinti, kad prie sterilizuojamų objektų lengvai prieitų garai, t. y. jeigu indai sterilizuojami konteineriuose, šie neturi būti aklinai uždaryti, kolbų kamščiai turi būti atlaisvinti.
5. Pieno agaro mitybinė terpė bendram bakterijų skaičiui nustatyti:
5.1. Terpės sudėtis ir paruošimas:
5.1.1. Terpės sudėtis:
| Mielių ekstrakto |
2,5 g; |
| Triptono |
5,0 g; |
| Gliukozės D (+) arba dekstrozės |
1,0 g; |
| Nugriebto pieno miltelių |
1,0 g; |
| Agaro |
(10–15) g priklausomai nuo naudojamo agaro sudaromo gelio tvirtumo; |
| Vandens |
1000 ml. |
5.1.2. Nugriebto pieno milteliuose neturi būti inhibitorinių medžiagų. Tai nustatoma atliekant palyginamuosius nugriebto pieno miltelių bandymus su nugriebto pieno milteliais be inhibitorinių medžiagų.
5.1.3. Komponentai ištirpinami ir išmaišomi vandenyje šia tvarka: mielių ekstraktas, triptonas, gliukozė ir nugriebto pieno milteliai. Komponentai lengviau ištirpsta šildant. Įdedamas agaras ir kaitinama iki virimo, kol agaras visai ištirpsta, arba tirpinama garuose apie 30 minučių. Jeigu būtina, filtruojama per filtro popierių.
5.2. Mitybinės terpės išpilstymas, sterilizacija ir laikymas:
5.2.1. Terpė (5.1 p.) išpilstoma į kolbutes po (100 – 150) ml arba į mėgintuvėlius (4.2.2 p.) po (12–15) ml. Kolbos ir mėgintuvėliai užkemšami.
5.3. Sausoji mitybinė terpė:
5.3.1. Mitybinę terpę (5.1 p.) galima paruošti iš sausosios mitybinės terpės. Tokiu atveju reikia laikytis gamintojo nurodymų, bet prieš ištirpinant sausąją mitybinę terpę, visada reikia pridėti nugriebto pieno miltelių, jei jų nėra tarp sudėtinių dalių.
6. Skiedikliai:
6.1. Peptono fiziologinio tirpalo sudėtis ir paruošimas:
6.1.2. Komponentai ištirpinami vandenyje, jeigu reikia, pašildomi. pH – metru (4.1.4 p.) patikrinamas pH ir, jeigu būtina, naudojant natrio hidroksido ar druskos rūgšties tirpalą (mažiausiai 0,1 mol/l koncentracijos), pH nustatomas toks, kad po sterilizacijos jis būtų (7,0 ± 0,1), matuojant 25°C temperatūroje.
6.2. Skiediklio išpilstymas, sterilizavimas ir laikymas:
6.2.1. Skiediklis (6.1 p.) išpilstomas į mėgintuvėlius (4.2.1 p.) tokiais kiekiais, kad po sterilizacijos mėgintuvėlyje liktų (9,0 ± 0,2) ml skiediklio. Mėgintuvėliai užkemšami.
6.2.2. Sterilizuojama autoklave (4.1.2 p.) 121 ± 1° C temperatūroje 15 minučių. Patikrinamas skiediklio pH.
7. Metodika:
7.1. Terpės ištirpinimas:
Prieš pradedant mikrobiologinį tyrimą, reikiamas terpės kiekis greitai ištirpinamas ir atšaldomas vandens vonioje (4.1.5 p.) iki (45 ± 1)°C temperatūros.
7.2. Pieno bandinio paruošimas:
Pieno bandinys kruopščiai išmaišomas, greitai vartant indą su pieno bandiniu 25 kartus, kad mikroorganizmai pasiskirstytų kiek galint tolygiau. Vengiama putų susidarymo. Laikotarpis tarp sumaišymo ir pieno mėginio paėmimo neturi trukti ilgiau kaip tris minutes.
7.3. Pirmojo skiedinio paruošimas (10-1) (žaliam ir pasterizuotam pienui):
Sterilia pipete (4.2.3 p.) įpilama 1 ml žalio ar pasterizuoto pieno mėginio (4.2.3 p.) į 9 ml skiediklio (6.1 p.), vengiant pipetės ir skiediklio sąlyčio. Skiediklio temperatūra turi būti apytikriai tokia pati, kaip ir pieno mėginio. Šis pirmasis skiedinys atsargiai maišomas 5-10 sekundžių maišytuve. Tokiu būdu gaunamas pirmasis skiedinys 10-1.
7.4. Tolesnių dešimtkarčių skiedinių ruošimas (žaliam ir pasterizuotam pienui):
1 ml pirmojo skiedinio (7.3 p.) sterilia pipete (4.2.3 p.) įpilama į 9 ml skiediklio (6.1 p.) pagal 7.3 p. pateiktas instrukcijas gaunamas 10-2 skiedinys. Šios procedūros kartojamos, kad būtų gauti tolesni dešimtkarčiai skiediniai, kol bus gautas tinkamas mikroorganizmų skaičius 1 ml.
7.5. Sėjimas į Petri lėkšteles:
7.5.1. Žalias pienas:
Į Petri lėkštelę (4.2.4 p.) sterilia pipete (4.2.3 p.) įpilama 1 ml mėginio ir/arba atitinkamas dešimtkartis skiedinys. Būtina ištirti mažiausiai du skiedinius. Kiekvienam pasirinktam skiediniui (8.1.1 p.) imama po vieną Petri lėkštelę.
7.5.2. Pasterizuotas pienas:
Į Petri lėkštelę (4.2.4 p.) sterilia pipete (4.2.3 p.) įpilama 1 ml mėginio ir/arba atitinkamas dešimtkartis skiedinys. Būtina ištirti mažiausiai du skiedinius. Kiekvienam pasirinktam skiediniui (8.1.1 p.) imama po dvi Petri lėkšteles.
7.6. Terpės supylimas:
7.6.2. Tuoj po išpilstymo pasėtas produktas sumaišomas su terpe, sukant Petri lėkštelę taip, kad po išlaikymo kolonijos pasiskirstytų tolygiai.
7.6.3. Pieno bandinys paruošiamas ir sumaišomas su terpe, priklausomai nuo pieno, mėginio ar skiedinio rūšies, ne ilgiau kaip per 15 minučių.
7.7. Petri lėkštelių inkubavimas:
7.7.1. Lėkštelės sudedamos į termostatą (4.1.3 p.). Lėkštelės termostate laikomos apverstos. Viena ant kitos sudedama ne daugiau kaip šešios lėkštelės. Lėkštelių krūvelės turi būti atskirtos viena nuo kitos ir nuo termostato sienelių ir viršaus.
7.8. Kolonijų skaičiavimas:
7.8.2. Lėkštelės apžiūrimos neryškioje šviesoje. Skaičiavimui palengvinti galima naudoti tinkamas lupas (4.1.6 p.) ir/arba skaitiklius (4.1.8 p.). Skaičiuojant labai mažas kolonijas svarbu nepriskaičiuoti neištirpusių dalelių ar nuosėdų. Įtartinus objektus vertinti rūpestingai: siekiant atskirti kolonijas nuo pašalinių medžiagų, panaudoti didesnio padidinimo lupas (4.1.7 p.).
7.8.3. Išsiplėtusios kolonijos laikomos pavienėmis kolonijomis. Jeigu mažiau kaip vienas ketvirtadalis paviršiaus priaugęs išsiplėtusių kolonijų, būtina jas skaičiuoti likusioje lėkštelės dalyje ir apskaičiuoti mikroorganizmų skaičių visoje lėkštelėje. Jeigu daugiau kaip vienas ketvirtadalis lėkštelės paviršiaus priaugę išsiplėtusių kolonijų, jos neskaičiuojamos.
8. Rezultatų apskaičiavimas ir išraiška:
8.1. Žalias ir pasterizuotas pienas:
8.1.1. Rezultatams skaičiuoti atrenkamos visos lėkštelės, kuriose išaugo nuo 10 iki 300 kolonijų (žr. 8.1.3 p. ir 8.1.4 p.).
8.1.2. Kolonijas sudarančių vienetų skaičius 1 ml žalio arba pasterizuoto pieno apskaičiuojamas pagal formulę:

čia: Σc suma kolonijų, suskaičiuotų kaip nurodyta 8.1.1 p.;
| (n1 + 0,1n2) d |
atitinka mėginio, įpilto į lėkštelę, tūrį, kur: |
| n1 |
pirmojo skiedinio lėkštelių skaičius; |
| n2 |
antrojo skiedinio lėkštelių skaičius; |
| d |
skiedimo koeficientas, atitinkantis pirmąjį skiedinį, kurio lėkštelės buvo atrinktos kolonijų skaičiavimui. Skaičiavimo rezultatas suapvalinamas iki dviejų reikšminių skaičių. Kai apvalinamas skaičius yra 5, suapvalinama į kairę taip, kad būtų gautas lyginis skaičius. |
8.1.3. Pavyzdys (pasterizuotas pienas):
Skiedinio 10 -2 rezultatai 278 ir 290 kolonijų;
Skiedinio 10 -3 rezultatai 33 ir 28 kolonijos
![]()
8.1.4. Jeigu yra tik lėkštelės, kuriose išaugo mažiau nei 10 kolonijų, mikroorganizmų skaičius 1 mililitre išreiškiamas kaip „mažesnis už 10 x d viename mililitre“; d yra žemiausio skiedinio laipsnį atitinkantis atvirkštinis dydis.
7 priedas
MIKROORGANIZMŲ SKAIČIAUS NUSTATYMO SĖJANT Į LĖKŠTELES 21°C TEMPERATŪROJE METODAS
1. Šis pamatinis metodas apibūdina mikroorganizmų skaičiaus nustatymą, naudojant sėjimo į lėkšteles 21°C temperatūroje metodą. Metodas taikomas pasterizuotam pienui, prieš tai 5 dienas išlaikytam 6°C temperatūroje, siekiant nustatyti pasterizuoto pieno užterštumą psichrotrofiniais mikroorganizmais, galinčiais daugintis piene 6°C temperatūroje.
2. Apibrėžimas:
Mikroorganizmai – tai organizmai, sugebantys suformuoti suskaičiuojamas kolonijas, laikant aerobinėmis nurodytomis sąlygomis.
3. Metodo esmė:
Pasterizuotas pienas išlaikomas 5 dienas 6°C temperatūroje. Tam tikras pieno bandinio tūris Petri lėkštelėse sumaišomas su mitybine terpe ir inkubuojamas 25 valandas 21°C temperatūroje. Suskaičiuojamos kolonijos ir apskaičiuojamas mikroorganizmų skaičius 1 ml pasterizuoto pieno.
4. Įranga ir stikliniai indai:
4.1. Naudojama įprastinė ir ši laboratorinė įranga:
4.1.3. Termostatai, kurių visoje erdvėje galima palaikyti:
4.2. Stikliniai indai:
4.2.1. Sandariai uždaromi, pakankamos talpos mėgintuvėliai, kuriuose galima sumaišyti 10 ml pirmojo skiedinio ar tolesnius dešimtkarčius skiedinius.
4.2.3. Pipetės (su vatos kamščiais), pagamintos iš stiklo ar sterilios sintetinės medžiagos, su nenudaužtu galu ir 1 ml talpos žyme, kurių ištekėjimo angos skersmuo (1,75–3) mm.
4.2.4. Petri lėkštelės, pagamintos iš skaidraus nespalvoto stiklo ar sterilios sintetinės medžiagos, kurių dugno vidinis skersmuo yra apie (90–100) mm. Jų gylis vidinėje dalyje turi būti mažiausiai 10 mm. Dugnas turi būti be nelygumų, trukdančių skaičiuoti kolonijas.
4.2.5. Stiklinių indų sterilizavimas:
4.2.5.1. Stikliniai indai turi būti sterilizuojami, naudojant vieną iš šių metodų:
4.2.5.1.1. išlaikant juos sterilizavimo krosnyje ne trumpiau kaip vieną valandą (170–175)°C temperatūroje (4.1.1 p.);
4.2.5.2. Būtina užtikrinti, kad autoklave prie sterilizuojamų objektų lengvai prieitų garai, t. y. jeigu indai sterilizuojami konteineriuose, jie neturi būti aklinai uždaryti, kolbų kamščiai turi būti atlaisvinti.
5. Pieno agaro mitybinė terpė bendram bakterijų skaičiui nustatyti:
5.1. Terpės sudėtis ir paruošimas:
5.1.1. Terpės sudėtis:
| Mielių ekstrakto |
2,5 g; |
| Triptono |
5,0 g; |
| Gliukozės D (+) arba dekstrozės |
1,0 g; |
| Nugriebto pieno miltelių |
1,0 g; |
| Agaro |
(10-15) g priklausomai nuo naudojamo agaro sudaromo gelio tvirtumo; |
| Vandens |
1000 ml. |
5.1.2. Nugriebto pieno milteliuose neturi būti inhibitorinių medžiagų. Tai nustatoma atliekant palyginamuosius nugriebto pieno miltelių bandymus su nugriebto pieno milteliais be inhibitorinių medžiagų.
5.1.3. Komponentai ištirpinami ir išmaišomi vandenyje šia tvarka: mielių ekstraktas, triptonas, gliukozė ir tada nugriebto pieno milteliai. Komponentai lengviau ištirpsta šildant. Įdedamas agaras ir kaitinama iki virimo, kol agaras visai ištirpsta, arba tirpinama garuose apie 30 minučių. Jeigu būtina, filtruojama per filtro popierių.
5.2. Mitybinės terpės išpilstymas, sterilizacija ir laikymas:
5.2.1. Terpė (5.1 p.) išpilstoma į kolbutes po (100–150) ml arba į mėgintuvėlius (4.2.2 p.) po (12–15) ml. Kolbos ir mėgintuvėliai užkemšami.
5.3. Sausoji mitybinė terpė:
5.3.1. Mitybinę terpę (5.1 p.) galima paruošti iš sausosios mitybinės terpės. Tokiu atveju reikia laikytis gamintojo nurodymų, bet prieš ištirpinant sausąją mitybinę terpę, visada reikia pridėti nugriebto pieno miltelių, jei jų nėra tarp sudėtinių dalių.
6. Skiedikliai:
6.1. Peptono fiziologinio tirpalo sudėtis ir paruošimas:
6.1.2. Komponentai ištirpinami vandenyje, jeigu reikia, pašildomi. pH – metru (4.1.4 p.) patikrinamas pH ir, jeigu būtina, naudojant natrio hidroksido ar druskos rūgšties tirpalą (mažiausiai 0,1 mol/l koncentracijos), pH nustatomas toks, kad po sterilizacijos jis būtų (7,0 ± 0,1), matuojant 25°C temperatūroje.
6.2. Skiediklio išpilstymas, sterilizavimas ir laikymas:
6.2.1. Skiediklis (6.1 p.) išpilstomas į mėgintuvėlius (4.2.1 p.) tokiais kiekiais, kad po sterilizacijos mėgintuvėlyje liktų (9,0 ± 0,2) ml skiediklio. Mėgintuvėliai užkemšami.
6.2.2. Sterilizuojama autoklave (4.1.2 p.) 121 ± 1°C temperatūroje 15 minučių. Patikrinamas skiediklio pH.
7. Metodika:
7.1. Terpės ištirpinimas:
Prieš pradedant mikrobiologinį tyrimą, reikiamas terpės kiekis greitai ištirpinamas ir atšaldomas vandens vonioje (4.1.5 p.) iki (45 ± 1)°C temperatūros.
7.2. Pieno bandinio paruošimas:
7.2.1. Neatidarytas pasterizuoto pieno pakelis, o jeigu tai neįmanoma, ne mažesnis kaip 100 ml reprezentyvinis bandinys, išlaikomas (120 ± 2) valandas termostate (4.1.3.1 p.), kurio temperatūra (6 ± 0,5)°C.
7.3. Pirmojo skiedinio paruošimas (10-1) (žaliam ir pasterizuotam pienui):
Sterilia pipete (4.2.3 p.) įpilama 1 ml žalio ar pasterizuoto pieno mėginio (4.2.3 p.) į 9 ml skiediklio (6.1 p.), vengiant pipetės ir skiediklio sąlyčio. Skiediklio temperatūra turi būti apytikriai tokia pati, kaip ir pieno mėginio. Šis pirmasis skiedinys atsargiai maišomas 5 – 10 sekundžių maišytuve. Tokiu būdu gaunamas pirmasis skiedinys 10-1.
7.4. Kitų dešimtkarčių skiedinių ruošimas (žaliam ir pasterizuotam pienui):
1 ml pirmojo skiedinio (7.3 p.) sterilia pipete (4.2.3 p.) įpilama į 9 ml skiediklio (6.1 p.) pagal 7.3 p. pateiktas instrukcijas gaunamas 10-2 skiedinys. Šios procedūros kartojamos, kad būtų gauti tolesni dešimtkarčiai skiediniai, kol bus gautas tinkamas mikroorganizmų skaičius 1 ml.
7.5. Sėjimas į Petri lėkšteles:
Į Petri lėkštelę (4.2.4 p.) sterilia pipete (4.2.3 p.) įpilama 1 ml mėginio ir/arba atitinkamas dešimtkartis skiedinys. Būtina ištirti mažiausiai du skiedinius. Kiekvienam pasirinktam skiediniui (8.1 p.) imama po dvi Petri lėkšteles.
7.6. Terpės supylimas:
7.6.2. Tuoj po išpilstymo pasėtas produktas sumaišomas su terpe, sukant Petri lėkštelę taip, kad po išlaikymo kolonijos pasiskirstytų tolygiai.
7.7. Petri lėkštelių inkubavimas:
7.7.1. Lėkštelės sudedamos į termostatą (4.1.3.2 p.). Lėkštelės termostate laikomos apverstos. Viena ant kitos sudedama ne daugiau kaip šešios lėkštelės. Lėkštelių krūvelės turi būti atskirtos viena nuo kitos ir nuo termostato sienelių ir viršaus.
7.8. Kolonijų skaičiavimas:
7.8.2. Lėkštelės apžiūrimos neryškioje šviesoje. Skaičiavimui palengvinti galima naudoti tinkamas lupas (4.1.6 p.) ir/arba skaitiklius (4.1.8 p.). Skaičiuojant labai mažas kolonijas svarbu nepriskaičiuoti neištirpusių dalelių ar nuosėdų. Įtartinus objektus vertinti rūpestingai, kur reikia naudojant didesnio padidinimo lupas (4.1.7 p.) tam, kad būtų galima atskirti kolonijas nuo pašalinių medžiagų.
7.8.3. Išsiplėtusios kolonijos laikomos pavienėmis kolonijomis. Jeigu mažiau kaip vienas ketvirtadalis paviršiaus priaugęs išsiplėtusių kolonijų, būtina jas skaičiuoti likusioje lėkštelės dalyje ir apskaičiuoti mikroorganizmų skaičių visoje lėkštelėje. Jeigu daugiau kaip viename ketvirtadalyje paviršiaus priaugę išsiplėtusių kolonijų, lėkštelė neskaičiuojama.
8. Rezultatų apskaičiavimas ir išraiška:
8.1. Rezultatams skaičiuoti atrenkamos visos lėkštelės, kuriose išaugo nuo 10 iki 300 kolonijų (žr. 8.3 ir 8.4 p.).
8.2. Kolonijas sudarančių vienetų skaičius 1 ml pasterizuoto pieno apskaičiuojamas pagal formulę:

čia: Σc suma kolonijų, suskaičiuotų kaip nurodyta 8.1.1 p.;
| (n1 + 0,1n2) d |
atitinka mėginio, įpilto į lėkštelę, tūrį, kur: |
| n1 |
pirmojo skiedinio lėkštelių skaičius; |
| n2 |
antrojo skiedinio lėkštelių skaičius; |
| d |
skiedimo koeficientas, atitinkantis pirmąjį skiedinį, kurio lėkštelės buvo atrinktos kolonijoms skaičiuoti. Skaičiavimo rezultatas suapvalinamas iki dviejų reikšminių skaičių. Kai apvalinamas skaičius yra 5, suapvalinama į kairę taip, kad būtų gautas lyginis skaičius. |
8.3. Pavyzdys (pasterizuotas pienas):
Skiedinio 10 -2 rezultatai 278 ir 290 kolonijų;
Skiedinio 10 -3 rezultatai 33 ir 28 kolonijos
![]()
8.4. Jeigu yra tik lėkštelės, kuriose išaugo mažiau nei 10 kolonijų, mikroorganizmų skaičių 1 mililitre išreiškiamas kaip „mažesnis už 10 x d viename mililitre“; d yra žemiausio skiedinio laipsnį atitinkantis atvirkštinis dydis.
KOLIFORMINIŲ BAKTERIJŲ SKAIČIAUS NUSTATYMAS PAGAL SKAIČIUOJAMAS KOLONIJAS 30°C TEMPERATŪROJE
1. Šis pamatinis metodas apibūdina koliforminių bakterijų, esančių pasterizuotame piene, skaičiaus nustatymą, naudojant kolonijų skaičiavimo metodą 30° C temperatūroje.
2. Apibrėžimas:
Koliforminės bakterijos yra bakterijos, kurios 30°C temperatūroje suformuoja būdingas arba nebūdingas kolonijas, kurios apibūdintomis sąlygomis suraugina laktozę ir sudaro dujas.
3. Metodo esmė:
Tam tikras pieno bandinio tūris Petri lėkštelėse sumaišomas su mitybine terpe ir inkubuojamas 24 valandas 30°C temperatūroje. Suskaičiuojamos būdingos kolonijos ir, jeigu būtina, patvirtinamas nebūdingų kolonijų tapatumas, nustatant jų pajėgumą fermentuoti laktozę. Po to apskaičiuojamas bakterijų skaičius 1 ml pasterizuoto pieno.
4. Įranga ir stikliniai indai:
4.1. Įprastinė laboratorinė įranga:
4.2. Stikliniai indai:
4.2.1. 20 ml talpos sandariai uždaromi mėgintuvėliai patikrinimo testo terpei (5.2 p.) laikyti ir atitinkamų išmatavimų Durham vamzdeliai (plūdės), naudojami su mėgintuvėliais.
4.2.3. Pipetės (su vatos kamščiais), pagamintos iš stiklo ar sterilios sintetinės medžiagos, su nenudaužtu galu ir (1–10) ml talpos žyme, kurių ištekėjimo angos skersmuo (1,75–3) mm.
4.2.4. Petri lėkštelės, pagamintos iš skaidraus nespalvoto stiklo ar sterilios sintetinės medžiagos, kurių dugno vidinis skersmuo yra apie (90 – 100) mm. Jų gylis vidinėje dalyje turi būti mažiausiai 10 mm. Dugnas turi būti be nelygumų, trukdančių skaičiuoti kolonijas.
4.2.5. Stiklinių indų sterilizavimas:
4.2.5.1. Stikliniai indai turi būti sterilizuojami, naudojant vieną iš šių metodų:
4.2.5.1.1. išlaikant juos sterilizavimo krosnyje ne trumpiau kaip vieną valandą (170–175)°C temperatūroje (4.1.1 p.);
4.2.5.2. Būtina užtikrinti, kad autoklave prie sterilizuojamų objektų lengvai prieitų garai, t. y. jeigu indai sterilizuojami konteineriuose, jie neturi būti aklinai uždaryti, kolbų kamščiai turi būti atlaisvinti.
5. Mitybinės terpės:
5.1 Violetiniai raudonas tulžies, laktozės agaras (VRBL agaras):
5.1.1. Mitybinės terpės sudėtis:
| Peptono |
7 g; |
| Mielių ekstrakto |
3 g; |
| Laktozės (C12H22O11. H2O) |
10 g; |
| Natrio chlorido (NaCl) |
5 g; |
| Tulžies rūgšties druskos |
1,5 g; |
| Neutralaus raudonojo indikatoriaus |
0,03 g; |
| Kristalinio violetinio indikatoriaus |
0,002 g; |
| Agaro |
(10–15) g priklausomai nuo naudojamo agaro sudaromo gelio tvirtumo; |
| Vandens |
1000 ml. |
5.1.2. Komponentai atsveriami ir ištirpinami vandenyje, paliekama stovėti keletą minučių, po to energingai išmaišoma.
5.1.3. pH – metru (4.1.4 p.) patikrinamas terpės pH ir, jeigu būtina, naudojant natrio hidroksido ar druskos rūgšties tirpalą (mažiausiai 0,1 mol/l koncentracijos), pH nustatomas toks, kad po sterilizacijos jis būtų (7,4 ± 0,1), matuojant 25°C temperatūroje. Terpė greitai užvirinama, kartais pamaišant, ir tuoj pat išpilstoma į sterilias (100 – 150) ml talpos kolbutes (4.2.2 p.). Terpė atšaldoma vandens vonioje (4.1.5 p.) (45±1)°C temperatūroje.
5.2. Laktozės, tulžies, briliantinės žalumos sultinys. Patikrinimo testo terpė:
5.2.1. Mitybinės terpės sudėtis:
| Peptono |
10 g; |
| Laktozės (C12H22O11. H2O) |
10 g; |
| Bevandenės jaučių tulžies |
20 g; |
| Briliantinės žalumos |
0,0133 g; |
| Vandens |
1000 ml. |
Komponentai ištirpinami vandenyje užverdant.
5.2.2. pH – metru (4.1.4 p.) patikrinamas terpės pH ir, jeigu būtina, naudojant natrio hidroksido ar druskos rūgšties tirpalą (mažiausiai 0,1 mol/l koncentracijos), pH nustatomas toks, kad po sterilizacijos jis būtų (7,4 ± 0,1), matuojant 25°C temperatūroje.
5.2.3. Terpė išpilstoma po 10 ml į mėgintuvėlius (4.2.1 p.) su Durham vamzdeliais (plūdėmis). Mėgintuvėliai užkemšami.
5.2.4. Sterilizuojama autoklave (4.1.2 p.) (121±1)°C temperatūroje 15 minučių. Po sterilizacijos plūdėse neturi būti oro burbulų.
6. Metodika:
6.2. Pieno bandinio paruošimas:
Pieno bandinys kruopščiai išmaišomas, greitai vartant indą su pieno bandiniu 25 kartus, kad mikroorganizmai pasiskirstytų kiek galint tolygiau. Vengiama putų susidarymo. Laikotarpis tarp sumaišymo ir pieno mėginio paėmimo neturi trukti ilgiau kaip tris minutes.
6.3. Sėjimas į Petri lėkšteles:
3 ml pieno bandinio (6.2 p.) sterilia pipete (4.2.3 p.) supilstomi po 1 ml pieno bandinio į kiekvieną iš trijų lėkštelių (4.2.4 p.).
6.4. Išpilstymas:
6.4.2. Sumaišoma tuoj pat įpylus agarą, sukant Petri lėkštelę taip, kad po išlaikymo kolonijos pasiskirstytų tolygiai.
6.4.3. Laikas nuo pieno bandinio paruošimo iki jo sumaišymo su terpe neturi būti ilgesnis kaip 15 minučių.
6.5. Petri lėkštelių inkubavimas:
Lėkštelės sudedamos į termostatą (4.1.3 p.). Lėkštelės termostate laikomos apverstos. Viena ant kitos sudedama ne daugiau kaip šešios lėkštelės. Lėkštelių krūvelės turi būti atskirtos viena nuo kitos ir nuo termostato sienelių ir viršaus. Termostate lėkštelės inkubuojamos (24±2) valandas (30±1)°C temperatūroje.
6.6. Kolonijų skaičiavimas:
6.6.1. Kolonijos suskaičiuojamos Petri lėkštelėse, kuriose išaugę ne daugiau kaip 150 kolonijų. Suskaičiuojamos tamsiai raudonos spalvos kolonijos, būdingos koliforminėms bakterijoms, kurių skersmuo ne mažesnis kaip 0,5 mm.
6.7. Patikrinimo testas:
Pagal 6.6.2 p. nurodytus požymius atrenkamas tinkamas nebūdingų kolonijų skaičius (pvz., nuo trijų iki penkių) ir atliekamas patikrinimo testas, pasėjant jas metaline kilpele (4.1.6 p.) į laktozės, tulžies, briliantinės žalumos sultinį (5.2 p.) ir auginant (30±1)oC temperatūroje (24±2) valandas. Koliforminėmis bakterijomis laikomos tos kolonijos, kurios plūdėse sudaro dujas.
7. Rezultatų apskaičiavimas ir išraiška:
7.1. Rezultatams skaičiuoti (žr. 7.4 p.) naudojamos tos lėkštelės, kuriose išaugo ne daugiau kaip 150 kolonijų.
7.2. Jeigu atliekamas patikrinimo testas, koliforminių bakterijų kolonijų skaičius lėkštelėje apskaičiuojamas iš patikrintų koliforminių bakterijų kolonijų procento.
7.3. 1 ml pasterizuoto pieno esantis koliforminių bakterijų skaičius išreiškiamas pagal formulę:

čia: Σ c bendras koliforminių bakterijų kolonijų skaičius (7.1 p. kartu su 7.2 p.), nustatytas tiriant pieno bandinį (3 ml),
n ištirto bandinio (6.3 p.) mililitrų skaičius (3 ml).
7.4. Kai išauga daugiau nei 100 kolonijų, skaičiavimo rezultatas suapvalinamas iki dviejų reikšminių skaičių. Kai skaičius, kurį reikia suapvalinti, yra penki, suapvalinama į kairę taip, kad būtų gautas lyginis skaičius.
9 priedas
SOMATINIŲ LĄSTELIŲ SKAIČIAUS NUSTATYMAS
1. Šiame priede apibūdinti du pamatiniai somatinių ląstelių skaičiaus nustatymo metodai:
2. Mikroskopinis metodas apibūdina somatinių ląstelių skaičiaus pieno bandinyje nustatymą žaliame piene ir taikomas kalibruojant ir patikrinant fluorooptoelektroninio metodo tikslumą (žr. 9 p.).
3. Apibrėžimas:
Šiame metode somatinės ląstelės yra tos ląstelės, kurių branduolį galima aiškiai nudažyti metileno mėliu, pvz., leukocitai ir epitelinės ląstelės.
4. Metodo esmė:
0,01 ml pieno paskleidžiama ant 1 cm2 mikroskopo stiklo. Susidariusi plėvelė išdžiovinama ir nudažoma. Suskaičiuojamos nusidažiusios ląstelės, stebint pro mikroskopą. Norint nustatyti ląstelių skaičių 1 ml pieno, tam tikrame plote suskaičiuotos ląstelės padauginamos iš tam tikro darbinio koeficiento.
5. Reagentai:
Naudojami tik analiziškai gryni reagentai:
5.1. Dažančiojo tirpalo sudėtis:
metileno mėlio – 0,6 g;
99% etanolio – 54,6 ml;
1,1,1 – trichloretano arba tetrachloretano – 40,6 ml (Tetrachloretanas yra nuodingas. Jo tirpalai turi būti ruošiami ir jais naudojamasi traukos spintoje);
ledinės acto rūgšties – 6,6 ml.
5.2. Dažančiojo tirpalo paruošimas:
Butelyje sumaišoma etanolis ir 1,1,1 – trichloretanas arba tetrachloretanas ir mišinys kaitinamas (60-70)oC vandens vonioje. Pridedama metileno mėlio ir atsargiai išmaišoma, per 12-24 valandas šaldytuve atšaldoma iki 4oC temperatūros, tada pridedama ledinės acto rūgšties. Išfiltruojama per filtrą, kurio porų dydis nuo 10 iki 12 mikronų ar mažesnis. Dažantysis tirpalas laikomas sandariai uždaromame butelyje. Jeigu susidaro dalelės arba nuosėdos, prieš naudojant perfiltruojama.
6. Įranga ir stikliniai indai:
6.3. Mikroskopo stiklai, turintys pažymėtą 20 mm × 5 mm būsimos plėvelės kontūrą, arba etaloninis mikroskopo stiklas, kurio matmenys 20 mm × 5 mm.
7. Metodika:
7.1. Pieno bandinys:
Pieno bandinys turi būti ištirtas per šešias valandas nuo jo paėmimo. Laikymo metu bandinio temperatūra neturi viršyti 6oC. Vengti užšalimo.
7.2. Bandinio paruošimas laboratorijoje:
Bandinys vandens vonioje (6.6 p.) pašildomas iki (30–40) oC temperatūros. Po to atsargiai išmaišomas ir atšaldomas iki mikrošvirkšto (6.2 p.) kalibravimo temperatūros, pvz., iki 20 oC.
7.3. Išankstinis mikroskopo stiklų paruošimas:
Mikroskopo stiklai nuvalomi, pavyzdžiui, etanoliu, nusausinami nedulkančiu popieriumi, palaikomi liepsnoje ir atvėsinami. Laikomi dėžutėje, kad neapdulkėtų.
7.4. Plėvelės paruošimas:
7.4.1. Iš paruošto, kaip aukščiau nurodyta, pieno bandinio mikrošvirkštu (6.2 p.) paimama 0,01 ml pieno. Kruopščiai nuvaloma išorinė švirkšto dalis, kuri lietėsi su pienu. Švirkštu ant mikroskopo stiklo (6.3 p.) iš pradžių nubrėžiamas (20 mm × 5 mm) formos kontūras ir ant jo kaip galima vienodžiau paskleidžiamas pienas. Plėvelė visiškai išdžiovinama, naudojant horizontalią plytelę (6.4 p.).
7.5. Plėvelių dažymas:
Mikroskopo stiklas su plėvele 10 minučių panardinamas į dažantįjį tirpalą (5 p.). Jeigu reikia, džiovinti baigiama džiovintuvu (6.5 p.). Plėvelė merkiama į tekantį vandenį, kol nusiplauna visas dažų perteklius. Po to vėl išdžiovinama ir laikoma, saugant nuo dulkių.
8. Suskaičiavimas ir apskaičiavimas:
8.1. Ląstelių suskaičiavimas ir apskaičiavimas:
Mikroskopu (6.1 p.) suskaičiuojamos ne ląstelės, o tik ląstelių branduoliai. Jie turi būti aiškiai atpažįstami ir ne mažiau kaip pusė branduolių turi būti matomi mikroskopo lauke. Branduoliai skaičiuojami plėvelės viduriniame trečdalyje vertikaliomis juostelėmis; neskaičiuojama pasirenkant tik pakraštines plėvelės juosteles. Plėvelių paruošimo tinkamumas ir rezultatų patikimumas turi būti tikrinami ne rečiau kaip vieną kartą per mėnesį, suskaičiuojant branduolius skirtingose plėvelės plotuose. Branduolius galima suskaičiuoti paskirsčius sistemoje mikroskopo laukus taip, kad visos plėvelės dalys būtų reprezentuojamos vienodai.
8.2. Mažiausias nustatomas ląstelių skaičius:
8.2.1. Kadangi mikroskopiniu somatinių ląstelių skaičiavimo metodu gali būti tikrinamos automatinio ir mechanizuoto skaičiavimo metodikos ir kalibruojami prietaisai, identiškų bandinių, ištirtų šiuo metodu, gautas rezultatų variacijos koeficientas turi neviršyti nuokrypio, gaunamo skaičiuojant ląsteles elektroniniu matavimo prietaisu. Pieno bandinių, kuriuose yra nuo 400 000 iki 600 000 ląstelių/ml, variacijos koeficientas turi neviršyti 5%.
8.2.2. Norint patenkinti rezultatų pakartojamumo reikalavimą, somatinių ląstelių skaičius kiekviename bandinyje pagal Puasono pasiskirstymo dėsnį turi būti ne mažiau kaip 400.
8.2.3. Puasono pasiskirstymo dėsniui būdinga prielaida, kad
M=V=Sn2,
čia:
M – vidutinė dydžio vertė (vidurkis);
V – dispersija;
Sn – vidutinis kvadratinis nuokrypis.
8.3. Darbinio koeficiento apskaičiavimas:
Naudojant 0,01 ml pieno, koeficientas apskaičiuojamas pagal 8.3.1 p. arba 8.3.2 p.
8.3.1. Plėvelės juostelių suskaičiavimas:
Kiekvienos skaičiuojamos juostelės ilgis turi būti 5 mm. Juostelės plotis atitinka mikroskopo lauko skersmenį, nustatomą mikrometro stiklu (6.7 p.). Darbinis koeficientas apskaičiuojamas pagal formulę:
![]()
čia: d – mikroskopo lauko skersmuo, nustatytas mikrometro stiklo (6.7 p.) pagalba, mm;
b – suskaičiuotų juostelių skaičius.
8.4. Ląstelių skaičiaus apskaičiavimas:
Norint nustatyti ląstelių skaičių, esantį 1 ml pieno, suskaičiuotų somatinių ląstelių skaičius (8.1 ir 8.2 p.) dauginamas iš darbinio koeficiento.
9. Fluorooptoelektroninis metodas apibūdina somatinių ląstelių nustatymą žaliame ir chemiškai konservuotame piene, naudojant tinkamai kalibruotą (žr. 2 p.) fluorooptoelektroninį dalelių skaitiklį.
10. Apibrėžimas:
Šiame metode somatinės ląstelės yra ląstelės, kurių branduolių nudažyta DNR lemia mažiausią fluorescencijos intensyvumą.
11. Metodo esmė:
Pieno mėginys (pvz., 0,2 ml) gerai sumaišomas su buferiniu tirpalu ir fluorescenciniu tirpalu. Dalis šio mišinio paskleidžiama plonu sluoksneliu ant sukamojo disko, atstojančio mikroskopo stebimąją plokštumą. Kiekviena ląstelė sukuria elektroninį impulsą, kuris sustiprinamas ir užrašomas. Somatinių ląstelių skaičius parodomas tiesiogiai tūkstančiais vienam mililitrui pieno.
12. Reagentai:
Naudojami tik analiziškai gryni reagentai, jeigu nenurodyta kitaip, ir distiliuotas, dejonizuotas ar analogiško grynumo vanduo:
12.1. Buferinis tirpalas:
12.1.1. Buferinio tirpalo sudėtis:
Natrio vandenilio ftalato – 51,0 g;
Kalio hidroksido – 13,75 g;
1% (pagal tūrį) polietilenglikolio mono-p-(1,1,3,3-tetrametilbutil)fenilo eterio (pvz., trinitrotoluolo X-100) – 10 ml.
12.2. (pagrindinis tirpalas):
12.3. Fluorescencinis tirpalas (darbinis tirpalas):
20 ml pagrindinio tirpalo (12.2 p.) sumaišoma su buferiniu tirpalu (12.1 p.), norint gauti 1000 ml tirpalo. Darbinio tirpalo negalima naudoti ilgiau kaip 7 dienas.
12.4. Perplovimo tirpalas:
12.4.1. Perplovimo tirpalo sudėtis:
Buferinio tirpalo (12.1 p.) – 10 ml.
1% (pagal tūrį) polietilenglikolio mono-p-(1,1,3,3-tetrametilbutil)fenilo eterio (pvz., trinitrotoluolo X-100) – 10 ml.
25 % (pagal tūrį) amoniako – 25 ml.
13. Įranga ir stikliniai indai:
13.1. Skaitiklinis matuoklis, veikiantis optiniu fluorescenciniu principu:
13.1.1. Prieš naudojant būtina atlikti prietaiso kalibravimą. Taip nustatomas ryšys tarp suskaičiuojamų dalelių tūrio ir kritinio skaičiaus, virš kurio atliekamas skaičiavimas. Prietaisas kalibruojamas pagal gamintojo nurodymus, naudojant pieno bandinius, kurių ląstelės buvo suskaičiuotos mikroskopiniu metodu (2-8 p.).
14. Pieno bandinys:
14.1. Bandinys turi būti laikomas mėgintuvėlyje (15.3 p.) žemoje temperatūroje. Jeigu bandinys nekonservuotas, jis neturi būti tiriamas pirmąsias 24 valandas po pamelžimo, nes skaičiavimo rezultatas bus labai mažas. Laikymo temperatūra turi neviršyti 6oC.
14.2. Konservavimas:
Cheminis konservavimas turi būti atliekamas kaip galima greičiau po bandinio paėmimo, bet ne vėliau kaip per 24 valandas:
14.2.1. Bandinį galima chemiškai konservuoti, pridedant vieną iš šių konservantų:
14.2.1.1. ortoborato rūgšties, kurios galutinė koncentracija bandinyje turi neviršyti 0,6 g/100 ml. Taip konservuotas bandinys gali būti laikomas ne ilgiau kaip 24 valandas (6-12)°C temperatūroje;
14.2.1.2. kalio dichromato, kurio galutinė koncentracija bandinyje turi neviršyti 0,2 g/100 ml. Taip konservuoti bandiniai gali būti laikomi 72 valandas (6-12)oC temperatūroje;
14.2.1.3. natrio azido, kurio galutinė koncentracija bandinyje turi neviršyti 0,024 g/100 ml ir su sąlyga, kad bandinys tuojau pat po paėmimo atšaldomas iki (6-12)oC temperatūros ir jo tyrimas atliekamas per 48 valandas po bandinio paėmimo;
14.2.2. Ortoborato rūgštimi konservuotas bandinys gali būti konservuojamas dar 48 valandoms, naudojant kalio dichromatą.
15. Metodika:
15.1. Išankstinis bandinio apdorojimas:
Tiriamasis pienas laikomas (2-6)oC temperatūroje ne trumpiau kaip 24 valandas po pamelžimo. Pamelžimo dieną nekonservuotus bandinius tirti nepatartina, nes galima gauti labai mažus rezultatus. Jeigu tokį bandinį būtina ištirti, jis turi būti iš anksto apdorojamas, pridedant kalio dichromato (žr. 14.2.1.2 p.) ir palaikytas ne mažiau kaip tris valandas.
15.2. Paruošimas:
Konservuotas (žr. 15.1 p.) arba nekonservuotas, mažiausiai vienos dienos senumo bandinys pašildomas vandens vonioje (13.2 p.) iki 40oC ir iki tyrimo laikomas kambario temperatūroje.
15.3. Ląstelių suskaičiavimas:
15.3.1. Ląstelės turi būti suskaičiuojamos naudojant skaitiklinį matuoklį (13.1 p.) per 15 minučių nuo bandinio kaitinimo pabaigos (žr. 15.2 p.). Prieš suskaičiuojant bandinys turi būti kruopščiai išmaišytas, kad ląstelės kaip galima vienodžiau pasiskirstytų.
16. Tikslumas:
16.1. Nėra tarptautiniais tarplaboratoriniais bandymais patvirtintų duomenų apie metodo pakartojamumą (r) ir atitikimą (R). Ateityje metodo tikslumo duomenys bus pateikti.
16.2. Nacionalinių tarplaboratorinių tyrimų palyginimas rodo, kad ląstelių skaičiui esant nuo 400 000 iki 500 000 1 mililitre, metodo tikslumo lygis yra toks:
16.2.1. Etaloninio pakartojamumo nuokrypis sr = 20 000 ląstelių/ml (tai atitinka variacijos koeficientą nuo 4 % iki 5%).
10 priedas
ANTIBIOTIKŲ IR SULFAMIDŲ NUSTATYMAS
1. Šis pamatinis metodas apibūdina antibiotikų ir sulfamidų nustatymą žaliame ir termiškai apdorotame piene. Pamatinis metodas apima:
1.1. Kokybinį metodą, kuris yra pirminis metodas, skirtas antibiotikais ir sulfamidais užterštiems pieno bandiniams atrinkti. Apibūdintame metode kaip testavimo kultūra naudojamas Bacillus stearothermophilus var calidolactis ATTC 10149.
2. Kokybinis metodas taikomas kokybiniam antibiotikų ir sulfamidų aptikimui žaliame ir termiškai apdorotame piene, kai jų kiekiai viršija lentelėje nurodytas ribas:
Įvairių antibiotikų ir sulfamidų aptinkamos koncentracijos1.
|
|
Tyrimo jautrumas |
|
| Visi neigiami |
Visi teigiami |
|
| Benzilpenicilinas |
0,002 |
0,006 |
| Ampicilinas |
0,002 |
0,005 |
| Kloksacilinas |
0,015 |
0,035 |
| Nafcilinas |
0,006 |
0,011 |
| Tetraciklinas |
0,10 |
0,40 |
| Oksitetraciklinas |
0,20 |
0,45 |
| Chlortetraciklinas |
0,15 |
0,50 |
| Chloramfenikolis |
7,0 |
15,0 |
| Dihidrostreptomicinas |
4,0 |
13,0 |
| Neomicinas |
1,0 |
22,0 |
| Kanamicinas |
9,0 |
28,0 |
| Bacitracinas |
0,06 |
0,14 |
| Eritromicinas |
1,0 |
2,25 |
| Rifamicinas |
0,01 |
0,14 |
| Diafenilsulfonas |
0,01 |
0,1 |
| Sulfametazinas (Sulfadimidinas) |
0,5 |
1,0 |
1 Benzilpenicilinas ir bacitracinas išreikšti TV/ml, visi kiti antibiotikai – mg/ml.
3. Apibrėžimas:
Laikoma, kad piene yra antibiotikų arba sulfamidų, kai terpės spalva nepasikeičia (žr. 8.1 p.).
4. Metodo esmė:
Pieno bandinys kartu su mitybinėmis medžiagomis įpilamas į agaro gelį, kuriame yra pH indikatorius ir Bacillus stearothermophilus var calidolactis ATCC 10149 sporos (žr. 6.4.1 p.), pasižyminčios geru bendruoju jautrumu antibiotikams ir ypač jautrios užterštumui penicilinu. Inkubacijos metu mikroorganizmams dauginantis, susidaro rūgštis, dėl to pH indikatoriaus spalva keičiasi iš violetinės į geltoną. Jeigu piene yra medžiagų, trukdančių mikroorganizmų augimui, pH indikatoriaus spalva išlieka violetinė.
5. Įranga ir stikliniai indai:
5.1. Naudojama įprastinė laboratorinė ir ši įranga:
5.1.4. Pipetės su vienkartinio naudojimo antgaliukais, kuriais galima paimti ir įpilti po 0,1 ml bandinio.
5.2. Stikliniai indai:
5.2.1. Bandinių buteliukai su tinkamais kamščiais:
Tam tikri guminiai kamščiai gali nusėsdinti inhibitorines medžiagas ant buteliuko kaklelio.
5.2.2. Petri lėkštelės, pagamintos iš skaidraus nespalvoto stiklo ar sterilios sintetinės medžiagos su vienodo storio plokščiais dugnais, kurių minimalus vidinis skersmuo yra apie 140 mm.
5.2.4. Pipetės, pagamintos iš stiklinės arba sterilios sintetinės medžiagos, užkemšamos vata, kurių talpa 1 ml ir 10 ml.
5.2.7. Stiklinių indų sterilizavimas:
5.2.7.1. Stikliniai indai turi būti sterilizuojami, taikant vieną iš šių metodų:
5.2.7.1.1. Išlaikant juos sterilizavimo krosnyje ne trumpiau kaip vieną valandą (170-175)°C temperatūroje.
5.2.7.2. Būtina užtikrinti, kad autoklave prie sterilizuojamų objektų lengvai prieitų garai, t. y. jeigu indai sterilizuojami konteineriuose, jie neturi būti aklinai uždaryti, kolbų kamščiai turi būti atlaisvinti.
6. Terpė, tirpalai, testavimo mikroorganizmas:
Terpės komponentai turi būti tinkami bakteriologiniams tikslams. Naudojamas vanduo turi būti distiliuotas arba demineralizuotas, arba analogiško grynumo vanduo. Jame neturi būti medžiagų, trukdančių testavimo mikroorganizmui augti:
6.1. Terpės:
6.1.1. Mitybinis agaras:
6.1.1.1. Mitybinio agaro sudėtis:
mielių ekstrakto – 2 g;
peptono – 5 g;
mėsos ekstrakto – 1 g;
natrio chlorido – 5 g;
agaro – 10-15 g;
vandens – 1000 ml.
6.1.1.2. Mitybinio agaro paruošimas:
Terpės komponentai ištirpinami vandenyje. Užverdama kartais pamaišant. pH nustatomas toks, kad po sterilizacijos jis būtų (7,4±0,1), matuojant 25°C temperatūroje.
6.1.1.3. Išpilstoma į mėgintuvėlius po 10 ml taip, kad vėliau agaras sustingtų nuožulniai, arba po 100 ml į butelius.
6.1.2. Agaro terpė:
6.1.2.1. Agaro terpės sudėtis:
natrio chlorido – 2 g;
agaro – 15 g;
vandens – 1000 ml;
trimetoprimo ar tetroksoprimo tirpalo (žr. 6.1.3 p.)1 – 10 ml.
6.1.2.2. Terpės paruošimas:
Terpės komponentai, išskyrus trimetoprimą ar tetroksoprimą, ištirpinami vandenyje. Užverdama kartais pamaišant. Pridedama trimetoprimo ar tetroksoprimo ir 15 minučių sterilizuojama (121+1)°C temperatūroje, po to nustatomas pH taip, kad po sterilizavimo jis būtų (7,0±0,1), matuojant 25°C temperatūroje.
6.1.3. Trimetoprimo ar tetroksoprimo tirpalas:
6.1.3.1. Trimetoprimo ar tetroksoprimo tirpalo sudėtis:
trimetoprimo – 5 mg arba tetroksoprimo – 30 mg;
96% etilo spirito – 5 ml/30 ml;
vandens iki 1000 ml.
16.1.4. Mitybinės medžiagos:
16.1.4.1. Mitybinių medžiagų sudėtis:
mielių ekstrakto – 0,75 mg;
gliukozės – 5,0 mg;
tirpaus krakmolo – 8,0 mg;
bromkrezolo purpurinio indikatoriaus – 0,025 g;
vandens – iki 50 ml.
6.2. Etaloniniai penicilino tirpalai:
6.2.1. 60 μg/ml (100 TV/ml) penicilino tirpalas paruosiamas, ištirpinant kristalinį natrio arba kalio benzilpeniciliną steriliame distiliuotame vandenyje sandariai uždaromame steriliame butelyje.
6.2.2. Penicilino darbinis tirpalas paruošiamas, 1,25 ml penicilino tirpalą (6.2.1 p.) praskiedžiant iki 1000 ml steriliu distiliuotu vandeniu. Šiame darbiniame tirpale yra 0,075 μg (0,125 TV/ml) penicilino.
6.2.3. 75 ml etaloninio penicilino tirpalo, kuriame yra 0,004 μg/ml (0,0067 TV/ml) penicilino paruošiama, į 71 ml pieno be inhibitorių (6.3 p.) pridedant 4 ml darbinio penicilino tirpalo (5.2.2 p.) ir išmaišant.
6.3. Pienas be inhibitorių:
Kontrolei naudojamas pienas be inhibitorių gaunamas ištirpinant steriliame distiliuotame vandenyje nugriebto pieno miltelius (10% pagal masę tūryje), kuriuos ištyrus nustatyta, kad juose nėra inhibitorinių medžiagų. Arba pakankamas žalio pieno kiekis, kurį ištyrus nustatyta, kad jame nėra inhibitorinių medžiagų, gali būti išpilstytas į butelius, kaitinamas vieną valandą 100°C temperatūroje ir po to laikomas šaldytuve 0–6°C temperatūroje ne ilgiau kaip vieną savaitę.
6.4. Testavimo mikroorganizmas:
6.4.1. Bacillus stearothermophilus var calidolactus padermė ATCC 10149 naudojama kaip testavimo mikroorganizmas. Padermė yra identiška C953.
6.4.2. Testavimo kultūros palaikymui paruošiama kolekcinė kultūra. Testavimo kultūra laikoma ant nuožulniai sustangdinto mitybinio agaro (6.1.1 p.). Testavimo kultūra kilpele pasėjama ant nuožulniai sustangdinto agaro paviršiaus ir inkubuojama aerobinėmis sąlygomis 48 valandas (63±1)°C temperatūroje. Po inkubacijos mėgintuvėlis užkemšamas steriliu guminiu kamščiu. Tokiu būdu gauta pagrindinė kultūra gali būti laikoma keletą mėnesių šaldytuve (0–5)°C temperatūroje.
6.5. Testavimo kultūra (sporų suspensija):
6.5.1. 20 ml mitybinio agaro (6.1.1 p.) steriliai įpilama į sterilią Petri lėkštelę (4.2.2 p.) ir atšaldoma iki kambario temperatūros.
6.5.2. Į mėgintuvėlį su pagrindine kultūra sterilia pipete (5.2.4 p.) įpilama 5 ml sterilaus distiliuoto vandens ir sterilia kilpele nuo nuožulniai sustangdinto agaro nuplaunamos sporos. Ši sporų suspensija turi būti laikoma (0–5)°C temperatūroje ir sunaudojama per 36 valandas.
6.5.3. Į lėkštelę su mitybiniu agaru (6.5.1 p.) sterilia pipete (5.2.4 p.) įpilama 0,5 ml sporų suspensijos (6.5.2 p.) ir pasėta kultūra glaistikliu kruopščiai išskirstoma per visą paviršių. Inkubuojama (63±1)°C temperatūroje (5.1.1 p.) 16-18 valandų.
Jeigu naudojama pagrindinė kultūra (6.4.2 p.) arba ilgiau kaip 36 valandas išlaikyta kultūra, ją reikia persėti mažiausiai du kartus ir laikas tarp persėjimų turi būti ne ilgesnis kaip 36 valandos.
6.5.4. Į lėkštelę su kultūra (6.5.3 p.) sterilia pipete (5.2.4 p.) įpilama 10 ml distiliuoto vandens ir glaistikliu sporos nuo paviršiaus perkeliamos į suspensiją. Sporų suspensija įpilama į butelį (5.2.3 p.), kuriame yra 250 ml sterilaus distiliuoto vandens. Butelis uždaromas ir jo turinys kruopščiai suplakamas. Kultūros, kurių nereikia tuoj pat persėti, laikomos šaldytuve (0-6)°C temperatūroje.
6.5.5. Sporų suspensijoje gyvybingų kolonijų skaičius turi būti nuo 5 iki 10 milijonų 1 ml, sėjant į bendro bakterijų skaičiaus agaro terpę, inkubuotą (63±1)°C temperatūroje 16-18 valandų. Sporų suspensija turi būti vienodai drumsta visame tūryje, ir jeigu joje yra nuosėdų, ji išmetama ir iš pagrindinės kultūros paruošiama nauja suspensija.
6.6. Mėgintuvėlių/ampulių paruošimas:
6.6.2. Viena dalis šviežios sporų suspensijos (6.5.4 p.) gerai sumaišoma su penkiomis agaro terpės, esančios mėgintuvėlyje ar butelyje, dalimis (6.6.1 p.).
6.6.3. 0,3 ml terpės su sporomis (6.6.2 p.), apskaičiavus, kad bus gautas 5 mm storio sluoksnis, įpilama į sterilų mėgintuvėlį ar ampulę (5.2.6 p.) ir uždaroma kamščiu arba dangteliu, arba užlydoma viršūnė. Mėgintuvėliams ar ampulėms leidžiama atvėsti vertikalioje padėtyje, kad terpė sukietėtų, ir po to paliekama stovėti ne mažiau kaip 12 valandų.
7. Metodika:
7.1. Bandiniai turi būti tiriami kaip galima greičiau ir pageidautina per 24 valandas po jų paėmimo, iki tyrimo laikant (0-5)°C temperatūroje. Jei bandinių tyrimo negalima atlikti per 24 valandas, jie turi būti laikomi smarkiai užšaldyti (nuo minus 30 iki minus 15°C), siekiant kaip galima sumažinti penicilino inaktyvaciją.
7.2. Kiekvienas mėgintuvėlis ar ampulė (6.6 p.) pažymimi įskaitomais ir neištrinamais ženklais. Nuimamas dangtelis ar kamštis. Reikiamas skaičius tiriamųjų ir kontrolinių bandinių mėgintuvėlių sudedama į tinkamą stovelį (5.1.3 p.).
7.3. Į kiekvieną mėgintuvėlį ar ampulę įpilama po 50 mikrolitrų 6.1.4 p. nurodytų mitybinių medžiagų.
7.4. Pieno bandinys gerai išmaišomas ir 0,1 ml bandinio pipete (5.1.4 p.) įpilama į atitinkamai pažymėtą mėgintuvėlį arba ampulę. Kiekvienam bandiniui įpilti naudojamas švarus vienkartinio naudojimo antgaliukas.
7.5. Du kartus pakartojama 7.4 p. aprašyta operacija, vietoj pieno bandinio įpilant etaloninį penicilino tirpalą (6.2.3 p.), kuriame yra 0,004 μg/ ml (0,0067 TV/ml) penicilino.
7.6. Du kartus pakartojama 7.4 p. aprašyta operacija, kontrolei vietoj pieno bandinio naudojant pieną be inhibitorių (6.3 p.).
7.7. Mėgintuvėliai ar ampulės uždaromi ir stovelis su mėgintuvėliais ar ampulėmis įdedamas į vandens vonią (5.1.2 p.), kurioje palaikoma (63±1)°C temperatūra, ir išlaikomas joje nuo 2 h 30 min iki 2 h 45 min.
8. Rezultatų vertinimas:
8.1. Jeigu visuose tiriamųjų ir kontrolinių bandinių mėgintuvėliuose ar ampulėse terpė nusidažo violetine spalva, tai rodo, kad bandiniuose yra antibiotikų arba sulfamidų ir jų kiekis yra toks, koks nurodytas lentelės skiltyje „visi teigiami“. Mėgintuvėlių ar ampulių su etaloniniu penicilino tirpalu (7.5 p.) spalva turi būti violetinė, kad parodytų pakankamą bandymų terpės jautrumą.
8.2. Jeigu violetine spalva nusidažo tik dalis tiriamųjų bandinių mėgintuvėlių ar ampulių terpės arba jei kai kurių iš jų terpė nusidažo netolygiai, inhibitorinių medžiagų kiekis bandinyje yra tarp lentelėje pateiktų reikšmių.
8.3. Jeigu kuriame nors iš tiriamųjų ar kontrolinių bandinių mėgintuvėlių ar ampulių bandymų terpė nusidažo geltona spalva, tai rodo, kad bandinyje nėra inhibitorinių medžiagų, stabdančių bandymo mikroorganizmo augimą.
9. Rezultatų patvirtinimas:
9.1. Bandinių, kurie atitinka 8.1 p. ir 8.2 p. apibūdinimą, rezultatai patvirtinami naudojant 10-18 p. apibūdintą metodą.
10. Penicilinų aptikimo bandinyje patvirtinimo ir jų koncentracijos nustatymo metodas skirtas patvirtinti penicilinų ar kitų antibiotikų aptikimą pieno bandiniuose ir nustatyti penicilino koncentraciją pieno bandiniuose, kurių rezultatai kokybiniu metodu buvo įvertinti kaip teigiami (8.1 p.) arba abejotini (8.2 p.).
Kokybinio įvairių antibiotikų ir sulfamidų nustatymo metodo jautrumas pateiktas 2 p.
11. Apibrėžimai:
11.1. Pieno bandinyje yra antibiotikų, iš jų sulfamidų, kai, pieno bandinį ištyrus apibūdintu metodu, aplink diską susidaro aiški, ne mažesnė kaip 2 mm inhibicijos zona.
11.2. Jeigu aplink bandinio, kuriame yra antibiotikų, iš jų sulfamidų (11.1 p.), ir į kurį įdėta penicilinazės (betalaktamazės), diską nesusidaro aiški inhibicijos zona arba jos skersmuo mažesnis negu zonos aplink bandinio be penicilinazės diską, tai reiškia, kad bandinyje esanti inhibitorinė medžiaga yra arba penicilinas, arba penicilinas kartu su kitais antibiotikais, tarp jų sulfamidais.
11.3. Jeigu zona nėra inaktyvuojama penicilinaze (11.2 p.), inhibitorinė medžiaga pieno bandinyje yra ne penicilinas, bet gali būti kito antibiotiko likutis.
Kai kurie iš pusiau sintetinių penicilinų, pvz., natrio kloksacilinas, nėra inaktivuojami penicilinaze arba inaktivuojami tik iš dalies, arba yra visiškai jai atsparūs ir todėl neidentifikuojami kaip penicilinas (žr. 16.3 p.).
12. Metodo esmė:
Pieno bandiniu sudrėkintas popieriaus diskas padedamas ant agaro terpės su Bacillus stearothermophilus var calidolactis sporomis paviršiaus. Inkubacijos metu mikroorganizmai auga ir tai yra atsirandančio agaro drumstumo priežastis. Jeigu piene yra medžiagų, trukdančių mikroorganizmams augti, aplink diską susidaro aiški inhibicijos zona. Aiškios zonos dydis, be kitų faktorių, priklauso ir nuo piene esančių inhibitorinių medžiagų koncentracijos ir tipo.
13. Įranga ir stikliniai indai:
13.1. Įranga:
14. Terpė, etaloniniai tirpalai, penicilinazės tirpalai, reagentai, testavimo mikroorganizmai ir kt.
Terpės sudėtinės dalys turi būti tinkamos bakteriologiniams tikslams. Naudojamas vanduo turi būti distiliuotas arba demineralizuotas, arba analogiško grynumo vanduo. Jame neturi būti medžiagų, trukdančių testavimo mikroorganizmui augti.
14.1. Terpė:
14.1.2. Terpė inhibitorinėms medžiagoms nustatyti:
14.1.2.1. Terpės inhibitorinėms medžiagoms nustatyti sudėtis:
mielių ekstrakto – 2,5 g;
triptono – 5 g;
gliukozės – 1 g;
trimetoprimo ar tetroksoprimo tirpalo (6.1.3 p.) – 10 ml;
agaro – 10-15 g (priklausomai nuo agaro gelio tvirtumo);
vandens – 1000 ml.
14.1.2.2. Terpės paruošimas.
Prieš pridedant į tirpalą trimetoprimo ar tetroksoprimo, sausieji terpės komponentai visiškai ištirpinami vandenyje šildant ir maišant. Pridėjus trimetoprimo ar tetroksoprimo tirpalo, terpės pH nustatomas taip, kad po sterilizavimo jis būtų 8,0±0,1, matuojant 25°C temperatūroje. Terpė sterilizuojama 15 minučių (121±1)°C temperatūroje.
14.2. Etaloniniai penicilino tirpalai piene (žr. 6.2 p.):
Norint kiekybiškai nustatyti inhibitorinių medžiagų kiekį, gaminami tokių koncentracijų etaloniniai penicilino tirpalai piene be inhibitorių (6.3 p.):
14.3. Penicilinazės tirpalas:
14.3.1. Steriliame distiliuotame vandenyje ištirpinamas pakankamas penicilinazės (betalaktamazės) kiekis, kad gauto tirpalo koncentracija būtų 1000 TV/ml. Šį tirpalą, pageidautina padalytą mažomis porcijomis, galima laikyti (0-5)°C temperatūroje iki keturių savaičių.
14.3.2. Nėra vieningo penicilinazės tarptautinio standarto. Šiame metode priimta, kad 10 vienetų penicilinazės pakanka inaktyvuoti 0,6 mg (1 TV) penicilino. Jeigu gaunamos penicilinazės aktyvumas nežinomas, būtinai reikia patikrinti, ar ši prielaida galioja. Priešingu atveju būtina atitinkamai pakeisti penicilinazės tirpalo koncentraciją.
14.6. Petri lėkštelių paruošimas:
14.6.1. Terpė, skirta inhibitorinėms medžiagoms nustatyti, (14.1.2 p.) ištirpinama ir atšaldoma iki 55°C.
14.6.2. Į butelį įpilama viena dalis šviežios sporų suspensijos (14.5 p.) ir tiek inhibitorinių medžiagų nustatymui skirtos terpės (14.1.2 p.) dalių, kad pasėtoje terpėje būtų gaunamas atitinkamas kolonijų tankis, ir kruopščiai sumaišoma.
14.6.3. Į pakaitintą iki 55°C temperatūros sterilią Petri lėkštelę (5.2.2 p.) įpilama terpės su sporomis (14.6.2 p.) (0,6–0,8) mm storio sluoksniu. Norint gauti 0,8 mm storio sluoksnį 140 mm vidinio skersmens Petri lėkštelėje, reikia apie 15 ml terpės.
14.6.4. Petri lėkštelės padedamos ant šalto horizontalaus paviršiaus, prieš tai patikrinto su spirito gulsčiuku, jų dangteliai nuimami ir leidžiama agaro terpei sustingti. Kai terpė sustingsta, dangteliai vėl uždedami ant lėkštelių ir jos apverčiamos, kad sumažintų kondensaciją ant agaro terpės paviršiaus.
14.6.5. Tokiu būdu paruoštas lėkšteles rekomenduojama naudoti tą pačią dieną, bet jas galima laikyti ir iki dviejų savaičių su sąlyga, kad tuoj po paruošimo jos laikomos sandariame polietileniniame maišelyje 5°C temperatūroje.
15. Metodika:
15.1. Bandinio paruošimas:
15.1.1. Bandiniai, kurių rezultatai kokybiniu metodu buvo įvertinti kaip teigiami (8.1 p.) arba abejotini (8.2 p.), turi būti tiriami iš naujo, juose identifikuojamas penicilinas ir nustatomas jo kiekis.
15.1.2. Iš pradžių šie pieno bandiniai 10 minučių kaitinami (80±1)°C temperatūroje, kad būtų išvengta termolabilių nespecifinių inhibitorių įtakos.
15.2. Inhibitorių aptikimas:
15.2.1. Popieriaus diskas (13.3 p.) panardinamas į pieno bandinį (15.1.2 p.), naudojant porą švarių, sausų pincetų. Pieno likutis pašalinamas, diską prispaudžiant prie bandinio butelio šono. Diskas lygiai padedamas ant lėkštelės (14.6 p.) ir pincetais atsargiai prispaudžiamas.
15.2.2. Paruošti diskai su skirtingais pieno bandiniais turi būti vienas nuo kito ne mažesniu kaip 20 mm atstumu ir ne mažesniu kaip 10 mm atstumu nuo krašto.
15.2.3. Tikrinant jautrumą etaloniniu penicilino tirpalu (14.2 p.), sudrėkinti diskai (13.3 p.) bet kokia tvarka padedami tarp pieno bandinių diskų taip, kad jų skaičius sudarytų ne mažiau kaip 2% pieno bandinių diskų skaičiaus. Kiekvienam bandymui turi būti naudojama ne mažiau kaip penki etaloniniai diskai.
15.2.4. Visus diskus bet kokia tvarka sudėjus ant agaro terpės ir juos identifikavus, lėkštelės apverčiamos ir inkubuojamos (63±1)°C temperatūroje nuo 2,5 iki 5 valandų.
15.2.5. Po inkubavimo lėkštelės apžiūrimos prieš tinkamą šviesos šaltinį, siekiant nustatyti aiškias inkubacijos zonas aplink popieriaus diską. Aiškios zonos išmatuojamos.
15.2.6. Zonos apie diskus, sudrėkintus etaloniniu penicilino tirpalu (15.2.3 p.), turi būti ne mažesnės kaip 2 mm.
15.3. Inhibitorinių medžiagų identifikavimas ir jų kiekio nustatymas:
15.3.1. 15.2.1 p. aprašytos operacijos atliekamos du kartus, naudojant pakaitinto pieno bandinį (15.1.2 p.) ir bandinį, apdorotą penicilinaze (15.1.3 p.). Vietoj pilamos penicilinazės į 10 ml pieno bandinį (14.3.2 p.) galima panardinti penicilinaze apdorotą diską ir jį padėti ant lėkštelės.
15.3.2. 15.2.1 punkte aprašyta operacija atliekama du kartus su kiekvienu iš 14.2.1 – 14.2.4 p. nurodytų etaloninių penicilinino tirpalų.
16. Rezultatų įvertinimas (žr. 11 p.):
16.1. Jeigu aplink diską, sudrėkintą pieno bandinyje, apdorotame penicilinaze, nėra aiškios zonos, bet apie diską, sudrėkintą pieno bandinyje yra aiški zona, kurios skersmuo lygus ar didesnis už zonos aplink diską, sudrėkintą etaloniniu penicilino tirpalu (14.2.1 p.), skersmenį, tai pieno bandinyje esančios inhibitorinės medžiagos koncentracija atitinka ne mažiau kaip 0,004 mg/ml natrio-(kalio)-benzil-penicilino.
16.2. Jeigu aiškios zonos apie diską, sudrėkintą penicilinaze, vidutinis skersmuo yra lygus aiškios zonos apie diską, sudrėkintą pieno bandiniu, vidutiniam skersmeniui, tai piene yra inhibitorinių medžiagų, kurių negalima inaktyvuoti su šiame metode panaudotomis penicilinazės koncentracijomis.
16.3. Jeigu aiškios zonos apie diską, sudrėkintą penicilinaze, vidutinis skersmuo yra mažesnis už aiškios zonos apie diską, sudrėkintą pienu, kaitintu pagal 6.1.2 p. nurodymus, vidutinį skersmenį, tai reiškia, kad piene yra penicilino kartu su kitais antibiotikais, iš jų sulfamidais, be to jame yra penicilino arba pusiau sintetinio penicilino, kurio negalima atpažinti šiame metode naudojamos penicilinazės koncentracijos pagalba. Sintetinių penicilinų, tokie kaip natrio kloksacilinas, šio bandymo sąlygomis galima neinaktyvuoti penicilinaze, ir todėl jie gali būti klasifikuojami kaip kiti, ne penicilino, inhibitoriai.
17. Penicilino kiekio nustatymas:
17.1. Penicilino kiekį galima nustatyti nubraižius standartinę kreivę arba apskaičiavus pagal zonų, gautų naudojant etaloninius penicilino tirpalus piene (14.2.1–14.2.4 p.), dydžius.
17.2. Standartinės kreivės nubraižymas:
Kadangi tarp penicilino koncentracijos log10 ir inhibicijos zonų skersmens yra tiesinė koreliacija, standartinę kreivę galima nubraižyti ant pusiau logaritminio popieriaus, penicilino koncentracijas atidedant ant logaritminės ordinatės, o inhibicijos zonų skersmenis – ant abscisės. Inhibitorinių zonų skersmuo apskaičiuojamas kaip dviejų vienodų bandymų vidurkis. Inhibicijos zonų skersmenų reikšmės atidedamos standartinių penicilino koncentracijų atžvilgiu ir gaunama standartinė kreivė.
17.3. Apskaičiavimas:
Pieno bandinyje esančio penicilino koncentraciją galima apskaičiuoti pagal inhibicijos zonų skersmenis, taikant lygtį arba standartinę kreivę. Kad bandymo rezultatai būtų tikslūs, inhibicinių zonų spinduliai turi būti ne mažiau kaip du kartus, bet ne daugiau kaip 5 kartus didesni už diskų spindulius.
18. Rezultatų išraiška:
18.1. Rezultatai išreiškiami nurodant penicilino kiekį, kuris lygus arba didesnis kaip 0,004 μg/ml (arba nurodant nustatytas koncentracijas) ar nurodant kitų, ne penicilino, inhibitorių kiekį.
11 priedas
PATOGENINIŲ MIKROORGANIZMŲ NUSTATYMAS
1. Šiame metode pateikti nurodymai, kurių privalu laikytis tikrinant patogeninių mikroorganizmų buvimą pasterizuotame piene.
2. Apibrėžimas:
2.1. Pagal šį metodą turi būti ištirtos tos bakterijų rūšys, kurios dažniausiai susijusios su maisto sukeliamomis ligomis.
2.2. Pasterizacija yra pieno apdorojimas, apsaugantis jį nuo termiškai neatsparių patogenų. Jeigu pasterizuotas pienas atitinka termiškai apdoroto geriamojo pieno privalomuosiuose reikalavimuose išdėstytus reikalavimus dėl bendro bakterijų skaičiaus, koliforminių bakterijų skaičiaus ir fosfatazės, specialus bandymas patogenams nustatyti reikalingas tik tuo atveju, kai įtariama, jog pienas susijęs su apsinuodijimo maistu protrūkiu.
3. Metodo esmė:
3.1. Metodo taikymą ir tyrimo dažnumą nustato įgaliotos valdžios institucijos, išduodančios termiškai apdoroto pieno, skirto prekiauti Europos Bendrijoje, nekenksmingumo sveikatai liudijimus.
4. Rezultatų protokolas:
Kiekvieno ištirto patogeninio mikroorganizmo rezultatas turi būti išreiškiamas patogeninių mikroorganizmų skaičiumi, 1 ml pieno arba jų buvimu ar nebuvimu pasterizuoto pieno tūryje, kuris priklauso nuo taikomo metodo. Protokole turi būti detaliai aprašytas taikytas metodas. Naudojant kultūrų terpes, turinčias antifoliatinių medžiagų, būtina laikytis patentavimo teisės aktų.
______________

